
| A. | 一定向正反应方向移动 | |
| B. | 一定向逆反应方向移动 | |
| C. | 不移动 | |
| D. | 可能向正反应方向移动,也可能向逆反应方向移动 |
分析 A、向体系中充入二氧化碳,平衡逆向移动,但二氧化碳的体积分数增大;
B、升高温度使平衡正向移动,二氧化碳的体积分数变大;
C、要想二氧化碳的体积分数变大,平衡一定移动;
D、结合A、B分析解答.
解答 解:A、向体系中充入二氧化碳,平衡逆向移动,但二氧化碳的体积分数增大,所以平衡不一定正向移动,故A错误;
B、升高温度使平衡正向移动,二氧化碳的体积分数变大,所以平衡不一定逆向移动,故B错误;
C、要使该平衡不移动,无非是使用催化剂或增大压强,但两者二氧化碳的体积分数都不变,所以要想二氧化碳的体积分数变大,平衡一定移动,故C错误;
D、可以减小氢气的浓度使平衡正向移动,使体系中二氧化碳的体积百分含量增大,也可以增加二氧化碳浓度使平衡逆向移动来增大二氧化碳的体积百分含量,故D正确;
故选D.
点评 本题考查化学反应速率的移动,侧重于学生的分析能力和基础知识的综合理解和运用的考查,为高频考点,注意相关基础知识的积累,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 澄清透明溶液中可能大量存在:Cu2+、Mg2+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液中可能大量存在:K+、NH4+、Cl-、I- | |
| C. | 加入A1能放出大人量H2的溶液中可能大量存在:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×l0-12的溶液中可能大量存在:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
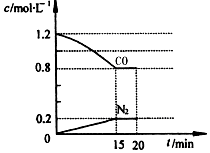 2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.2 g | B. | 22.4g | C. | 24.4g | D. | 26.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )和抗癫痫药物
)和抗癫痫药物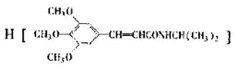 的路线如下(部分反应条件和试剂略去)
的路线如下(部分反应条件和试剂略去)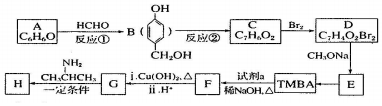
 +H2O(R、R′表示烃基或氢原子)
+H2O(R、R′表示烃基或氢原子)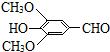 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→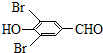 +2HBr.
+2HBr.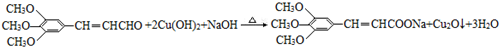 .
.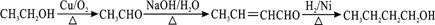 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,8,4,1,4 | B. | 2,16,5,2,8 | C. | 1,6,5,1,3 | D. | 1,8,5,1,4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氦气中有2NA个氦原子 | |
| B. | 14 g氮气中含6.02×1023个氮原子 | |
| C. | 2 L 0.3 mol•L-1 Na2SO4溶液中含0.6 NA个Na+ | |
| D. | 18 g水中所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com