
| A. | 蛋白质、淀粉、纤维素、葡萄糖等都能在人体内水解并提供能量 | |
| B. | 将甲烷和乙烯的混合气体通过盛有溴水的洗气瓶,即可提纯甲烷 | |
| C. | C2H6与氯气发生取代反应,C2H4与HCl发生加成反应,均可得到C2H5Cl | |
| D. | 用溴水一种试剂就可将苯、CCl4、乙酸、乙醇区别 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
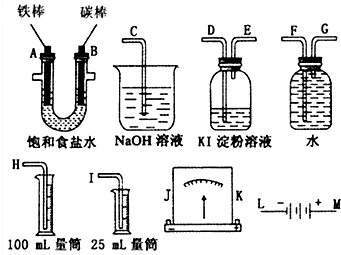 某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.
某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
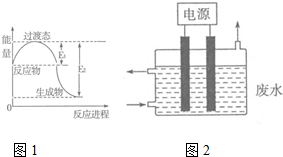 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
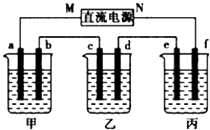 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
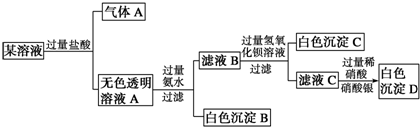
| A. | 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子 | |
| B. | 原溶液中是否存在Na+无法判断 | |
| C. | 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ | |
| D. | 生成沉淀B的离子方程式为:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜作电极电解NaCl溶液,可以实现反应:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑ | |
| B. | 用铜、铝作电极与电解质溶液构成原电池时,铜一定是正极 | |
| C. | N2O4和NO2混合气体69g,完全与水反应转移电子数约为6.02×1023 | |
| D. | HCl和HS-均是含有一个极性键的18电子粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水后振荡,看水层里是否有棕红色的溴出现 | |
| B. | 加入硝酸银溶液,再加稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH水溶液共热,冷却后加硝酸银溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH水溶液共热,冷却后用过量稀硝酸中和过量碱后,再加硝酸银溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
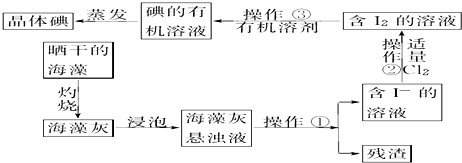
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com