
. 是重要的工业原料,铀浓缩一直为国际社会关注。下列有关
是重要的工业原料,铀浓缩一直为国际社会关注。下列有关 的说法正确的是
的说法正确的是
A、 原子核中含有92个中子 B、
原子核中含有92个中子 B、 原子核外有143个电子
原子核外有143个电子
C、 与
与 互为同位素 D、
互为同位素 D、 与
与 为同一核素
为同一核素
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
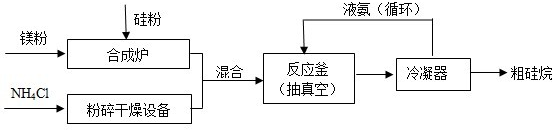
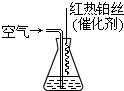 (2013?海淀区二模)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业.为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:
(2013?海淀区二模)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业.为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:
| ||
| ||


| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

 +2NaOH
+2NaOH| △ |
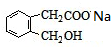 +CH3COONa+CH3CH2OH
+CH3COONa+CH3CH2OH +2NaOH
+2NaOH| △ |
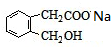 +CH3COONa+CH3CH2OH
+CH3COONa+CH3CH2OH

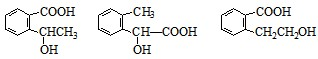 中任意一种
中任意一种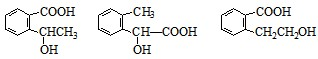 中任意一种
中任意一种| 催化剂 |
 (或CH2=CH2+H2O
(或CH2=CH2+H2O| 催化剂 |
| 催化剂 |
 (或CH2=CH2+H2O
(或CH2=CH2+H2O| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com