
某研究性学习小组为测定花溪河水中Ca2+的含量,取样100mL,经测定其中含Ca2+的质量为4mg,则该河水中Ca2+的物质的量浓度为
A.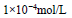 B.
B. C.
C.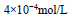 D.
D.
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源:2016-2017学年江苏省高一上期中化学试卷(解析版) 题型:选择题
“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物一定具有的性质是
A.无色透明 B.丁达尔效应
C.所得液体呈胶状 D.所得物质一定是悬浊液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南郸城高级中学高二上第二次考试化学卷(解析版) 题型:填空题
将等物质的量的A、B、C、D四种物质混合放入VL密闭容器中,发生如下反应:aA+bB cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了 n mol。此时反应达到平衡。
n mol。此时反应达到平衡。
(1)以B的浓度变化表示的该反应的速率为v (B)= 。
(2)该化学方程式中,各物质的化学计量数分别为:a b c d
(3)若只改变压强,反应速率变化但平衡状态不移动,则各物质的聚集状态分别是:A B D 。若在上述平衡混合物中再加入B物质,上述平衡
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.条件不够,无法判断
(4)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为 反应。(填“放热”或“吸热”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南郸城高级中学高二上第二次考试化学卷(解析版) 题型:选择题
在密闭容中发生下列反应aA(g) cC(g)+dD(g),达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a<c+d
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州贵阳花溪清华中学高一上月考一化学卷(解析版) 题型:选择题
某物质R是人类生命不可缺少的物质。已知R的摩尔质量为150g/mol,其中含碳元素40%,含氢元素6.7%,其余为氧元素。则R的化学式为
A.C5H10O2 B.C5H10O5 C.C6H6O D.C6H12O6
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州贵阳花溪清华中学高一上月考一化学卷(解析版) 题型:选择题
进行化学实验必须注意安全,下列说法不正确的是
A. 实验室中进行可燃性气体燃烧性质实验时,必须先验纯,后点燃
B. 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液
C. 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸
D. 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江大庆实验中学高三上期中化学卷(解析版) 题型:选择题
取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g ,另一份加入1000mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L,则所用硝酸的物质的量浓度为
A.0.8mol/L B.1.6mol/L C.0.9mol/L D.1.8mol/L
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上期中化学试卷(解析版) 题型:简答题
有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以 Fe3+离子的形式存在,则样品①的质量为_________g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量 (设为ag)范围是________。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3?三种离子中的一种离子的物质的量的变化曲线如下图所示,则该曲线表示的是物质的量变化的曲线,请你在此图中再画出另外两种离子的物质的量的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学卷(解析版) 题型:填空题
研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 反应Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g)△H2 =+41.2kJ•mol-1 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJ•mol-1 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
(1)研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是_________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)能说明反应Ⅱ已经达到平衡状态的是_____________。
A.混合气体的平均相对分子质量不变
B.混合气体的密度不变
C.v(H2)正>v(CO)正
D.n(CO)/n(H2)不变
(4)在恒容密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。
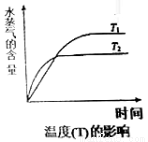
①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。则上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com