
| A. | 酸、碱、盐都是电解质 | |
| B. | H2O与D2O互称同素异形体 | |
| C. | 石油的分馏和裂化均属于化学变化 | |
| D. | 只含共价键的物质,一定是共价化合物 |
分析 A、电解质是指:在水溶液中或熔融状态下能够导电的化合物,非电解质是在水溶液中和熔融状态下都不能够导电的化合物,据此解答;
B、同素异形体的研究对象是同种元素形成的不同种单质;
C、石油分馏是利用熔沸点的不同分离混合物,属于物理变化;
D、双原子或三原子单质均含有共价键.
解答 解:A、酸碱盐在水溶液中或熔融状态下能电离出自由移动的离子而导电,属于化合物,是电解质,故A正确;
B、H2O与D2O均是由O元素和H元素构成的化合物,不是单质,故不是同素异形体,故B错误;
C、石油的分馏属于物理变化,故C错误;
D、氧气、氢气等均含有共价键,属于单质,不是化合物,故D错误,故选A.
点评 本题主要考查的是物理变化与化学变化的区别、电解质的感念、同素异形体概念等,难度不大,注意概念间的区分.


科目:高中化学 来源: 题型:选择题
| A. | WX2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2均为酸性氧化物 | |
| C. | WX2是以极性键结合成的非极性分子 | |
| D. | 最简单氢化物的稳定性:W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酯水解试验中,可以通过观察酯层消失的时间差异,来判断乙酸乙酯在不同条件下水解速率的差别 | |
| B. | 探究“温度影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入4mL溴水,再向其中加入10mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 实验室制备乙烯常用硫酸铜溶液洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示,放电时左槽溶液逐渐由黄变蓝,下列有关说法正确的是( )
全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示,放电时左槽溶液逐渐由黄变蓝,下列有关说法正确的是( )| A. | 左槽的惰性电极为该电池的正极,右槽的电极反应式为V2+-e-=V3+ | |
| B. | 充电过程中H+由右槽定向移动到左槽 | |
| C. | 充电时阴极的电极反应式 VO2++2H++e-=VO2++H2O | |
| D. | 若充电时,左槽溶液中n(H+)的变化量为2mol,则反应转移的电子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.
,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
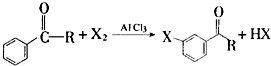


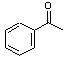 +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr
+HBr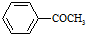 的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和
的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和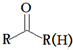 ,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
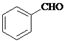 )和乙醇为原料合成苯乙酸乙酯,如图
)和乙醇为原料合成苯乙酸乙酯,如图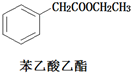 :
:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.
(1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| B. | Z元素的最高化合价为+7价 | |
| C. | W、X、Y、Z原子的核外最外层电子数的总和为17 | |
| D. | Y元素的最高价氧化物的对应水化物能溶解所有的金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com