
| A. | 在0.1 mol/L Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存 | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3- | |
| C. | 清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)?SO42-(aq)+CaCO3(s) | |
| D. | 向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-═BaSO4↓+Al(OH)3↓ |
分析 A.离子之间相互促进水解;
B.常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液,显碱性;
C.发生沉淀的转化;
D.加入少量Ba(OH)2溶液,不符合离子的配比.
解答 解:A.Al3+、CO32-相互促进水解,不能大量共存,故A错误;
B.常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液,显碱性,不能大量存在Fe2+,故B错误;
C.发生沉淀的转化,离子反应为CaSO4(s)+CO32-(aq)?SO42-(aq)+CaCO3(s),故C正确;
D.加入少量Ba(OH)2溶液,不符合离子的配比,离子反应为3Ba2++3SO42-+2Al3++6OH-═3BaSO4↓+2Al(OH)3↓,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、沉淀转化的离子反应考查,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
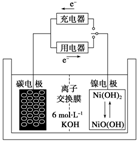 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向碳电极 | |
| B. | 放电时离子交换膜每通过4mol离子,碳电极质量减少12g | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 该电池充电时将镍电极与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是加成反应,反应②是取代反应 | |
| B. | 反应过程中可能会生成污染性气体 | |
| C. | C2H5OSO3H、乙醇均不能使酸性KMnO4溶液褪色 | |
| D. | 若不使用浓硫酸,乙烯仍能与水反应,但反应速率非常慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
| B | AgCl沉淀中滴入稀KI溶液 | 有黄色沉淀出现 | AgI比AgCl更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 淀粉与稀H2SO4共热,再加银氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).
已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 铝丝先放在NaOH溶液中浸泡1min,取出用蒸馏水冲洗后放在浓硝酸中浸10min,最后放入CuSO4溶液中,铝丝表面无铜析出,说明Al常温下与CuSO4溶液不反应 | |
| C. | 用浓盐酸配制1:1(体积比)的稀盐酸(约6mol/L)通常需要用容量瓶等仪器 | |
| D. | 固体碘单质受热易升华,说明碘单质的热稳定性差 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com