
【题目】为研究CH3COOH、HA和MOH的酸碱性的相对强弱,某兴趣小组设计了以下实验:室温下,将pH=2的两种酸溶液CH3COOH、HA和pH=12的碱MOH溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图1所示,根据所给数据,请回答下列问题: 
(1)HA为酸 (填“强”或“弱”).稀释后 HA溶液中水电离出来的 c(H+)醋酸溶液中水电离出来c(H+)(填“大于”、“等于”或“小于”).
若b+c=14,则MOH为碱(填“强”或“弱”).
(2)常温下0.10mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变大的是 .
A.c(H+)
B.c(H+)/c(CH3COOH)
C.c(H+)c(OH﹣)
D.c(OH﹣)/(H+)
(3)常温下,用0.10molL﹣1 NaOH溶液分别滴定20mL 0.10molL﹣1 HCl溶液和20mL 0.10 molL﹣1 CH3COOH溶液,得到两条滴定曲线,如图所示.如图中滴定醋酸溶液的曲线是(填“图2”或“图3”);曲线上E点pH>8的原因是(用离子方程式表示) .
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中离子浓度由大到小顺序为
【答案】
(1)强;大于;弱
(2)BD
(3)图3 ;CH3COO﹣+H2O ![]() ?CH3COOH+OH﹣
?CH3COOH+OH﹣
(4)c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
【解析】解:(1)pH=a的强酸,稀释10n倍后,溶液的pH=a+n,pH=a的弱酸,稀释10n倍后,溶液的pH介于a和a+n之间,据此可确定HA为强酸;稀释后 HA溶液PH大于醋酸溶液的PH,即HA溶液中c(H+)小于醋酸溶液中c(H+),溶液中c(H+)越小,对水的电离的抑制就越小,水电离的c(H+)越大;b+c=14则酸溶液中的c(H+)与碱中的c(OH﹣)相等,说明二者电离程度相同,故碱为弱碱,
所以答案是:强;大于;弱;(2)溶液中存在以下平衡CH3COOHCH3COO﹣+H+,加水平衡正移,
A、加水稀释PH增大,c(H+) 减小,故A错误;
B、 ![]() =
= ![]() ,平衡正移n(H+)增大,n(CH3COOH)减小,故比值增大,故B正确;
,平衡正移n(H+)增大,n(CH3COOH)减小,故比值增大,故B正确;
C、c(H+)c(OH﹣) 只与温度有关,加水不变,故C错误;
D、加水稀释PH增大,c(H+) 减小,c(OH﹣)增大,故二者比值增大,故D正确;
所以答案是:BD;(3)醋酸是弱酸,存在电离平衡,溶液PH变化慢,所以PH变化慢的是醋酸,即图3是醋酸的;当CH3COOH与NaOH恰好反应时生成的CH3COONa水解,溶液呈碱性,所以PH大于7水解方程为:CH3COO﹣+H2OCH3COOH+OH﹣,所以答案是:图3;CH3COO﹣+H2OCH3COOH+OH﹣;(4)CH3COOH与CH3COONa的混合溶液呈酸性,以CH3COOH的电离程度大于CH3COONa的水解程度所以c(CH3COO﹣)>c(Na+),溶液显酸性,c(H+)>c(OH﹣),因此c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣),所以答案是:c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣).


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.
可表示将SO2气体通入溴水时pH的变化
B.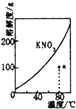
表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C.
表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.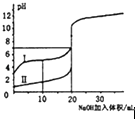
表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)( )
A.乙炔
B.丙炔
C.丁炔
D.丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A中含有KAl(SO4)2、Al2O3和Fe,在一定条件下可实现如图所示的物质之间的转化:
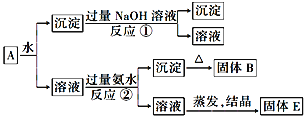
据此判断:
(1)固体B的化学式为________________,其归属的物质类别是:________________。
(2)固体E所含物质的化学式为________________。
(3)写出反应①的化学方程式:_______________________________。
(4)写出反应②的离子方程式:______________________________。
(5)某化学反应产物为Al2O3和Fe,此反应的名称是_________,化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。( )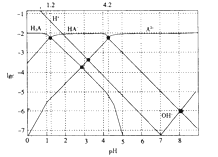
下列说法不正确的是
A.H2A是二元弱酸
B.HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C.0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2 , 可制得无水Na2SO3(成品),其流程如图所示。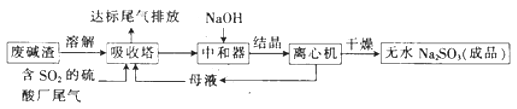
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为(不考虑H2O与SO2反应)。
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为(填“浊液”“胶体”或“溶液”)。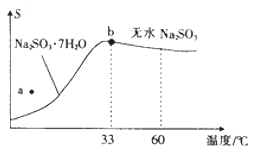
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32- , 原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1 , 为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:![]()
①洗涤时使用的试剂最好为(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y) (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为(若不能,则此空不填);若不能,则理由是(若能,则此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中能大量共存的无色透明离子组是
A. K+、Na+、NO3﹣、MnO4﹣ B. K+、Na+、Cl﹣、SO42﹣
C. K+、Na+、Br﹣、Cu2+ D. Na+、Ba2+、OH﹣、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com