
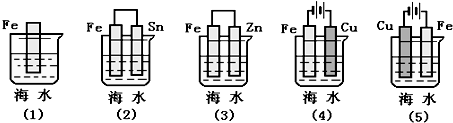
| A. | (5)(2)(1)(3)(4) | B. | (5)(1)(2)(4)(3) | C. | (4)(2)(1)(3)(5) | D. | (4)(3)(1)(2)(5) |
分析 作原电池负极和电解池阳极的金属易被腐蚀,作原电池正极或电解池阴极的金属易被保护,金属腐蚀快慢顺序是:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,(2)(3)装置是原电池,在(2)中,金属铁做负极,(3)中金属铁作正极,做负极的腐蚀速率快,并且两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,并且原电池原理引起的腐蚀>化学腐蚀,所以(2)>(3),
(4)(5)装置是电解池,(4)中金属铁为阴极,(5)中金属铁为阳极,阳极金属被腐蚀速率快,阴极被保护,即(5)>(4),
根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,
所以Fe片腐蚀由慢到快的顺序是:(4)(3)(1)(2)(5);
故选D.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道作原电池负极或电解池阳极的金属易被腐蚀,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铝熔点高达2045℃,可用于制成坩埚熔化氢氧化钠固体 | |
| B. | HF可以用于刻蚀玻璃 | |
| C. | 镁铝合金可用作制造飞机的材料 | |
| D. | 过氧化钠可用作供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | B. | Na+、Ba2+、Cl-、SO${\;}_{4}^{2-}$ | ||
| C. | NH${\;}_{4}^{+}$、Fe3+、Cl-、SCN- | D. | K+、Mg2+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂 | |
| D. | Y与Z形成的两种化合物中的化学键和晶体类型均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是1:2 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| D. | 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体中所含离子总数为4NA | |
| B. | 常温常压下,14gN2与CO组成的混合气体含有的原子数为NA | |
| C. | 1molCl2完全反应则转移电子数一定为2NA | |
| D. | Na2O2与水反应产生22.4LO2,则转移电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ/mol | |
| B. | 2SO2(g)+O2(g)?SO3(l)△H=-196.6 kJ/mol | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-122.9 kJ/mol | |
| D. | 2SO2(g)+O2(g)?SO3(g)△H=+196.6 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com