
| A�� | ��������ȼ�ϵ�ص�������Ӧ��H2-2e-+2OH-�T2H2O | |
| B�� | �õ���ʽ��ʾNaCl���γɹ��̣�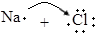 ��Na+[ ��Na+[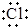 ]- ]- | |
| C�� | ������������ͨ��������Ƽ�����Һ�У�SO2+C1Oһ+2OH-�TSO42-+Cl-+H2O | |
| D�� | ����β��ϵͳ�Ĵ�ת�����ɽ���NO�ȵ��ŷţ�2CO+2NO$\frac{\underline{\;����\;}}{\;}$2CO2+N2 |
���� A����������ȼ�ϵ���У�������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ��
B��Naԭ�Ӻ�Clԭ��ͨ����ʧ�����γ����ӻ�����NaCl��
C����������ʹ������Ʒ���������ԭ��Ӧ���������ƺ�HCl��
D���ڴ��������£�CO��NO��Ӧ���ɶ�����̼�͵�����
��� �⣺A����������ȼ�ϵ���У�������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ��������ӦʽΪH2-2e-+2OH-�T2H2O����A����
B��Naԭ�Ӻ�Clԭ��ͨ����ʧ�����γ����ӻ�����NaCl���������γɹ���Ϊ ��Na+[
��Na+[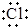 ]-����B��ȷ��
]-����B��ȷ��
C����������ʹ������Ʒ���������ԭ��Ӧ���������ƺ�HCl�����ӷ���ʽΪSO2+C1O-+2OH-�TSO42-+Cl-+H2O����C��ȷ��
D���ڴ��������£�CO��NO��Ӧ���ɶ�����̼�͵������Ӷ����ͻ�����Ⱦ����Ӧ����ʽΪ��2CO+2NO$\frac{\underline{\;����\;}}{\;}$2CO2+N2����D��ȷ��
��ѡA��
���� ���⿼�黷����Ⱦ��������ԭ��Ӧ������ʽ���缫��Ӧʽ����д��֪ʶ�㣬���ؿ���������ۣ���ȷ���ʵ������ǽⱾ��ؼ���ע��ԭ��ط�ӦʽҪ��ϵ������Һ�������д���״�ѡ����C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ�백ˮ��Ӧ��ȡ�������� | |
| B�� | ����ʯ��ˮʢװ���ò������������Լ�ƿ�� | |
| C�� | ������������ȼ�ղ�����ɫ���� | |
| D�� | ������ˮͨ����������ɫ�Լ�ƿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHCO3��Һ�����CO32-+2 H+=H2O+CO2�� | |
| B�� | ��������Һ��ͭ��Cu+Ag+=Cu2++Ag | |
| C�� | ��������ˮ��Ӧ��K+H2O�TK++OH-+H2�� | |
| D�� | �ô����ˮ����2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
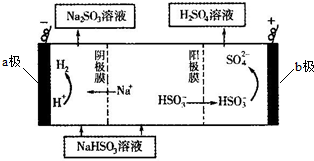
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
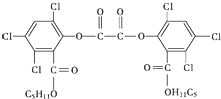 ��ħ�����������������ֳ����յ���Ⱦ����ħ��������ԭ��������H2O2��������������������������������ݸ�ӫ�����ʺ�㷢��ӫ�⣬���������CPPO���ṹ��ʽ��ͼ������˵������ȷ���ǣ�������
��ħ�����������������ֳ����յ���Ⱦ����ħ��������ԭ��������H2O2��������������������������������ݸ�ӫ�����ʺ�㷢��ӫ�⣬���������CPPO���ṹ��ʽ��ͼ������˵������ȷ���ǣ�������| A�� | CPPO������ˮ | |
| B�� | CPPO���ڷ�����Ҳ���ڸ߷��ӻ����� | |
| C�� | 1 mol CPPO��������ȫ��Ӧ����Ҫ10 mol H2 | |
| D�� | 1 mol CPPO��NaOHϡ��Һ��Ӧ�������DZ�������ԭ��ˮ�⣩���������4 mol NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | S��s��+O2��g����SO2��g��+Q1kJ��S��g��+O2��g����SO2��g��+Q2kJ | |
| B�� | H2��g��+$\frac{1}{2}$O2��g����H2O��l��+Q1kJ��H2��g��+$\frac{1}{2}$O2��g����H2O��g��+Q2kJ | |
| C�� | NaOH��aq��+HCl��aq����NaCl��aq��+H2O��l��+Q1kJ NaOH��aq��+HAc��aq����NaAc��aq��+H2O��l��+Q2kJ | |
| D�� | H2��g��+Cl2��g����2HCl��g��+Q1kJ��H2��g��+I2��g����2HI��g��+Q2kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ��Ӧʱ��t/s | 1 | 4 | 9 | 16 |
| �Ʋ���y/nm | a | 2a | 3a | 4a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧʽ | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp��Ka | Ksp=1.8��10-10 | Ksp=9.0��10-12 | Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.1��10-7 Ka2=5.6��10-11 |
| A�� | ��ͬŨ��CH3COONa��NaClO�Ļ����Һ�У���������Ũ�ȵĴ�С��ϵ�ǣ�c��Na+����c��ClO-����c��CH3COO-����c��OH-����c��H+�� | |
| B�� | ����������Һ��ͨ������CO2�����ӷ���ʽΪ��2ClO-+CO2+H2O=CO32-+2HClO | |
| C�� | ��0.1 mol•L-1CH3COOH��Һ�еμ�NaOH��Һ����c��CH3COOH����c��CH3COO-��=5��9����ʱ��Һ��pH=5 | |
| D�� | ��Ũ�Ⱦ�Ϊ1.0��10-3 mol•L-1��KCl��K2CrO4�����Һ�еμ�1.0��10-3 mol•L-1��AgNO3��Һ��CrO42-���γɳ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com