
在下图所示的有关物质转化关系中,各物质均是我们初中化学所学的物质。C为一种黑色粉末,D为一种气体。

请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀。则A为 ;D可能为 。
(2)若G为蓝色沉淀,H为难溶性盐,则I为 。
(3) 若G、H都属于盐,且G为蓝色溶液,则I可能为 ;F可能为 。
(1)A为Cu;D可能为H2或CO。(2)I为H2SO4。(3)I可能为HCl或H2SO4,F可能为AgNO3 或BaCl2。
由题中框图关系可知,黑色粉末与一种气体在加热条件下反应生成A、B两种物质,应为氧化铜被还原。因为D点燃可生成B,所以D为氢气,B为水,或D为CO,B为CO2,C为CuO,A为Cu。因CuO可与酸反应,所以I为酸,E为铜盐,当G为蓝色沉淀Cu(OH)2时,F应为可溶性碱,H为盐。因H为难溶性盐,则F为Ba (OH)2,H为
BaSO4,I为H2SO4。若G、H都属于盐,且G为蓝色溶液,则根据复分解反应的规律H为难溶性盐,若I为HCl,则E为CuCl2,F为AgNO3,G为Cu(NO3)2,H为AgCl;若I为H2SO4,则E为CuSO4,F为BaCl2,G为CuCl2,H为BaSO4。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:阅读理解
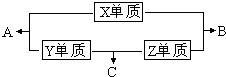 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
| ||
| △ |
| ||
| △ |
| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源:2004年高考北京四中全真模拟试卷·化学 题型:043
在中性或碱性溶液中Na2SO3与S可以顺利反应合成大苏打(Na2S2O3·5H2O);反应方程式如下:
Na2SO3+S+5H2O=Na2S2O3·5H2O现用Na2S和Na2CO3的混合溶液、Na2SO3固体、稀硫酸等试剂合成大苏打,按下列要求回答问题:
(1)制取SO2的化学方程式为________.
(2)反应过程中溶液的pH逐渐下降,同时有硫生成的有关反应的化学方程式是:
①________;②________;③________.
(3)合成大苏打时,Na2S与Na2CO3的最适宜的物质的量之比为________
(4)当溶液pH下降到7左右,在加热条件下,溶液变为无色澄清时,欲得Na2S2O3·5H2O晶体,可采取的措施是________
①趁热过滤 ②蒸发浓缩后冷却结晶
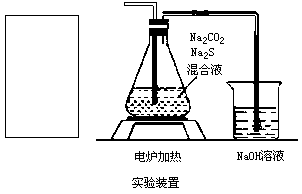
(5)在下图所示的方框中画出发生气体的实验装置示意图(包括反应时容器中的物质),已知气流方向从左到右(所用仪器的简要画法见如下说明).
①敞口玻璃容器 ;有塞玻璃容器
;有塞玻璃容器 ;普通漏斗
;普通漏斗 ;分液漏斗:
;分液漏斗: ;玻璃导管
;玻璃导管 或
或 ;(应标出在液面上或液面下).
;(应标出在液面上或液面下).
②铁架台、石棉网、酒精灯、玻璃导管之间的连接等,在示意图中不必画出.如需加热可在需加热的仪器下方标出“ “表示.
“表示.
查看答案和解析>>
科目:高中化学 来源:辽宁省沈阳二中2011-2012学年高一下学期期中考试化学试题 题型:058
用一定浓度的稀盐酸与稀NaOH溶液在下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.已知强酸与强碱的中和热为57.3 KJ/mol,水的比热容为4.2 J/(g·℃),有关热量与比热容的计算公式∶Q=m×c×Δt(Q为热量,m为物质的质量,c为比热容,Δt物质温度的变化值)
回答下列问题∶
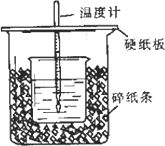
(1)从实验装置上看,图中尚缺少的一种玻璃用品是∶________
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL).
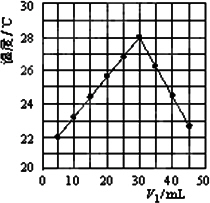
下列叙述正确的是________
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
(3)V1=30 mL时HCl和NaOH恰好反应,根据题中所给数据算出的温度变化值约为________(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7℃;两者相比所测结果偏低,造成如此现象的原因有∶________
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2SO3+S+5H2O ![]() Na2S2O3·5H2O
Na2S2O3·5H2O
现用Na2S、Na2CO3的混合液,Na2SO3固体和稀H2SO4等试剂合成大苏打,按下列要求回答问题:
(1)制取SO2的化学方程式 。
(2)反应过程中溶液的pH逐步下降,同时析出黄色硫的有关化学反应方程式是:
① 。
② 。
③ 。
(3)合成大苏打时,Na2S与Na2CO3的最适宜的物质的量之比为 。
(4)当溶液pH下降到7左右,在加热条件下,溶液变得无色澄清时,欲得Na2S2O3·5H2O晶体,可采取的措施是 。
①趁热过滤
②蒸发浓缩后冷却结晶
(5)在下图所示的方框中画出制取气体的实验装置示意图(包括反应时容器中的物质),已知气流方向从左到右。所用仪器的简单画法如下:
敞口玻璃容器![]() 有塞玻璃容器
有塞玻璃容器![]() 普通漏斗
普通漏斗![]() 分液漏斗
分液漏斗![]()
玻璃导管![]() (应标明在液面上或液面下)
(应标明在液面上或液面下)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com