
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、![]() 、
、![]() 、
、![]() 等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
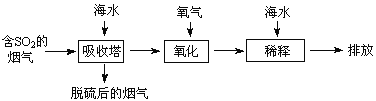
下列说法错误的是
A.海水pH约为8的原因主要是天然海水含![]() 、
、![]()
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将![]() 、SO32-、H2SO3氧化为
、SO32-、H2SO3氧化为![]()
D.经稀释“排放”出的废水中,![]() 浓度与海水相同
浓度与海水相同
【答案】D
【解析】
A、海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO-3等离子,在这些离子中能发生水解的是CO32-、HCO-3离子,CO32-+H2OHCO3-+OH-,HCO3-+H2OH2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,故A正确;
B、吸收塔中,二氧化硫能够与水反应生成亚硫酸,发生的反应有SO2+H2O![]() H2SO3,故B正确;
H2SO3,故B正确;
C、天然海水吸收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,被氧化的硫元素的化合价为+4价,具有还原性,所以氧气将H2SO3、HSO3-、SO32-等氧化为硫酸,如亚硫酸被氧化的反应为2H2SO3+O2=2H2SO4,故C正确;
D、从框图可知:排放出来的海水,是经过加天然海水中和、稀释经氧化后海水中生成的酸后排放的,溶液的体积显然比进入吸收塔的天然海水大,所以SO42-的物质的量浓度排放出来的海水中浓度小,故D错误;
故答案选D。


科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学把小块木炭在酒精灯上烧至红热,迅速投入热的浓硝酸中,发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧发出亮光。经查阅资料可知浓硝酸分解产生NO2和O2。为了探究“液面上木炭迅速燃烧发出亮光”的原因,该小组同学用如图装置完成以下实验:
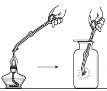
序号 | 实验I | 实验II |
集气瓶中所盛气体 | O2 | 加热浓硝酸 产生的气体 |
现象 | 木炭迅速燃烧发出亮光 | 木炭迅速燃烧发出亮光 |
下列说法正确的是
A. 浓硝酸分解产生的V(NO2):V(O2)=1:1
B. 红棕色气体的产生表明木炭与浓硝酸发生了反应
C. 能使液面上木炭迅速燃烧发出亮光的主要气体是氧气
D. 以上实验不能确定使液面上木炭迅速燃烧发出亮光的主要气体一定是NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO混合气体共8mol,通入足量Na2O2中,并且用电火花持续引爆,充分反应后,剩余气体1mol,则固体增重为多少克?( )
A.56gB.168gC.224gD.196g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________.
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________(填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.70 | 20.02 | 20.00 | 19.98 |
该样品中亚硝酸钠的质量分数为_________.(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是l mol金属镁和卤素反应的△H(单位:kJ· mol-1)示意图,反应物和生成物均为常温时的稳定状态,下列选项中不正确的是
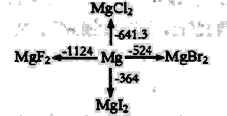
A.由图可知,MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ· mol-1
B.MgI2与Br2反应的△H<0
C.电解MgBr2制Mg是吸热反应
D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
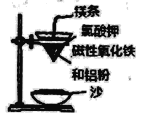
(l)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图)进行铝热反应,现象很壮观。使用镁条和氯酸钾的目的是___________。
(2)某同学取反应后的“铁块”和稀硝酸反应制备Fe(NO3)3溶液,其离子方程式为__________,溶液中可能含有Fe2+,其原因是___________;
(3)可通过KClO溶液与Fe(NO3)3溶液的反应制备高铁酸钾(K2FeO4),如图所示是实验室模拟工业制备KClO溶液装置。已知氯气和热碱溶液反应生成氯化钾和氯酸钾和水

①盛装饱和食盐水的B装置作用为______________;
②反应时需将C装置置于冷水浴中,其原因为___________;
(4)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0 mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如图所示:
①终点II的读数为_______mL。
②原样品中高铁酸钾的质量分数为_________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟的单质及含氟化合物用途非常广泛。回答下列问题:
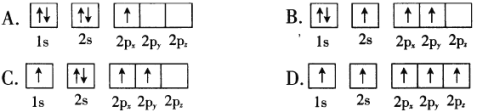
(1)BF3常用作有机反应的催化剂,下列B原子电子排布图表示的状态中,能量最低和最高的分别为____________、_______________。(填标号)
(2)NH4HF2(氟氢化铵)固态时包含的作用力有_______________(填标号)。
a.离子键 b.![]() 键 c.
键 c.![]() 键 d.氢键
键 d.氢键
(3)由反应2F2+2NaOH=OF2+2NaF+H2O可制备OF2。OF2的空间构型为___________,氧原子的杂化方式是_____________________________
(4)CsF是离子晶体,其晶格能可通过图(a)的born-Haber循环计算得到。
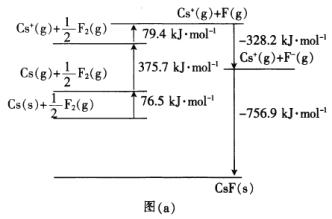
由图(a)可知,Cs原子的第一电离能为_______________________kJ·mol-1,F-F键的键能为________kJ·mol-1,CsF的晶格能为________kJ·mol-1。
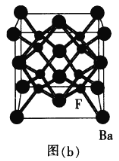
(5)BaF2晶胞是一种良好的闪烁晶体[如图(b)所示]。Ba2+的配位数为_________个;已知其密度为![]() ,则BaF2的晶胞参数为a=____________(设NA为阿伏加德罗常数的数值,列出计算式) nm。
,则BaF2的晶胞参数为a=____________(设NA为阿伏加德罗常数的数值,列出计算式) nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com