
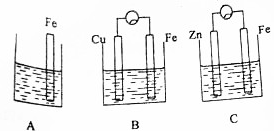
 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.分析 (1)两个活泼性不同的金属电极在电解质溶液中形成原电池反应,原电池反应是化学能转化为电能的装置;
(2)B中Fe极做原电池负极,失去电子发生氧化反应;
(3)装置C为原电池反应,锌做负极被氧化,反应为锌和稀硫酸反应生成硫酸锌和氢气;
(4)A中铁和稀硫酸直接发生反应生成氢气,装置B中铁做原电池负极,腐蚀速率增大,装置C中铁做原电池正极被保护.
解答 解:(1)图B装置形成的是原电池反应,Fe做负极失去电子发生氧化反应,溶液中氢离子在铜电极得到电子发生还原反应生成氢气,装置C中形成的也是原电池反应,锌做负极失电子风扇氧化反应,溶液中氢离子在Fe电极得到电子发生还原反应生成氢气,发生的是原电池反应,都是化学能转化为电能的装置,称为原电池,
故答案为:化学;电;原电池;
(2)B装置中Fe做原电池负极,失去电子发生氧化反应生成亚铁离子,电极反应为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
(3)C中被腐蚀的金属是Zn,总反应化学方程式为:Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+H2SO4=ZnSO4+H2↑;
(4)A中铁和稀硫酸直接发生反应生成氢气,发生的是化学腐蚀,装置B中铁做原电池负极,腐蚀的是电化腐蚀,腐蚀速率增大,装置C中铁做原电池正极被保护,A、B、C中被腐蚀的速率,由大到小的顺序是:B>A>C,
故答案为:B>A>C.
点评 本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:实验题
| 编号 | a | b |
| 试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
| 现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
| 实验方案 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 解释或结论 | |
| A | 充分浸透了 Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可用作木材防火剂 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中有Na+、无K+ |
| C | 分别向含有酚酞的烧碱溶液中通入氯气、二氧化硫 | 溶液颜色都变淺 | 说明氯气和二氧化硫都有 漂白性 |
| D | 向某加碘食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加 KIO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,H2O电解产物H2和O2的物质的量之比为2:1 | |
| B. | 相同条件下,H2O电解产物H2和O2的质量之比为2:1 | |
| C. | 相同条件下,1molH2与1molO2的体积相同 | |
| D. | 相同条件下,1molH2与1molO2的质量不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
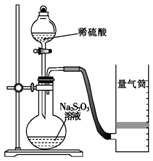 下面是某同学测定化学反应速率并探究其影响因素的实验.
下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com