
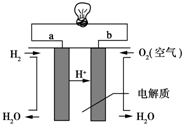
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.分析 (1)放电时,正极上PbO2得电子;
(2)该电池反应中,铜失电子发生氧化反应,作负极;根据电极方程式计算;
(3)原电池中失电子的一极为负极;
(4)①氢氧燃料电池的总反应即是氢气与氧气反应生成水;
②根据燃料电池的总反应方程式判断硫酸浓度的变化.
解答 解:(1)放电时,正极上PbO2得电子,正极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O,
故答案为:PbO2+4H++SO42-+2e-═PbSO4+2H2O;
(2)该电池反应中,铜失电子发生氧化反应,作负极;负极反应式为Cu-2e-=Cu2+,则当线路中转移0.2mol电子时,反应的Cu为0.1mol,其质量为6.4g,
故答案为:Cu;6.4;
(3)铝片和铜片插入浓HNO3溶液中,金属铝会钝化,金属铜和浓硝酸之间会发生自发的氧化还原反应,此时金属铜时负极,金属铝是正极;
插入稀NaOH溶液中,金属铜和它不反应,金属铝能和氢氧化钠发生自发的氧化还原反应,此时金属铝是负极,金属铜是正极,
故答案为:B;
(4)①氢氧燃料电池的总反应即是氢气与氧气反应生成水,其反应的总方程式为:2H2+O2=2H2O,
故答案为:2H2+O2=2H2O;
②已知氢氧燃料电池的总反应为:2H2+O2=2H2O,电池工作一段时间后,生成水使溶液体积增大,则硫酸的浓度减小,
故答案为:减小.
点评 本题考查了原电池原理的应用,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,蓄电池由化学能转化为电能 | |
| B. | 充放电时,溶液的导电能力变化不大 | |
| C. | 放电时的负极反应式为 Pb-2e-═Pb2+ | |
| D. | 充电时的阳极反应式为 Pb2++4OH-+2e-═PbO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②③④ | C. | ①②④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 混合物 | 试剂(足量) | 分离方法 |
| A | 苯(苯酚) | 浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 乙酸(乙醛) | 新制Cu(OH)2悬浊液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-22.5kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=+890kJ•mol-1 | |
| C. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=-890kJ•mol-1 | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=-1780kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com