
| A. | 乙烷和乙烯 | B. | 丙烯和丙烷 | ||
| C. | 甲烷和己烷 | D. | 乙炔和乙烯基乙炔( CH2=CH-C≡CH) |
分析 无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成CO2的质量也一定,则说明混合物各组分分子中含碳量相等,由于选项中都是由烃组成混合物,则满足条件的烃的最简式相同.
解答 解:无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成CO2的质量也一定,则说明混合物各组分分子中含碳量相等,若为烃类物质,则满足条件的烃的最简式相同,
A.乙烷与乙烯的最简式不同,则等质量时的含碳量不同,完全燃烧生成的二氧化碳不同,故A错误;
B.丙烯和丙烷的最简式不同,则含碳量不同,不符合题意,故B错误;
C.甲烷和己烷的最简式不同,则含碳量不同,不符合题意,故C错误;
D.乙炔和乙烯基乙炔( CH2=CH-C≡CH)的最简式都是CH,含碳量相同,符合题意,故D正确;
故选D.
点评 本题考查有机物燃烧的有关计算,题目难度不大,明确只要总质量一定,完全燃烧时生成CO2的质量也一定,说明混合物各组分分子中含碳量相等为解答关键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在[Cu(NH3)4]2+离子中,Cu2+给出空轨道,NH3提供孤对电子 | |
| B. | 生成了深蓝色的[Cu(NH3)4]2+,[Cu(NH3)4]SO4在乙醇中的溶解度较小 | |
| C. | 碱式硫酸铜与氨水反应的离子方程式:Cu2(OH)2SO4+8NH3•H2O=2[Cu(NH3)4]2++SO42-+2OH-+8H2O | |
| D. | 深蓝色晶体中只含有离子键、配位键和氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨与1mol金刚石完全燃烧放出的能量同样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氯乙烷的结构式CH3Cl | |
| B. | 丁烷的结构简式CH3(CH2)2CH3 | |
| C. | 氯化氢分子的形成过程可用电子式表示为: | |
| D. | 四氯化碳的电子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)如图所示的原电池装置,Cu电极反应式为2H++2e-=H2↑;当导线上通过2.408×1022个电子时,锌片质量减少1.3g.
(1)如图所示的原电池装置,Cu电极反应式为2H++2e-=H2↑;当导线上通过2.408×1022个电子时,锌片质量减少1.3g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
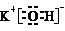 ;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.
;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 气体通过盛有足量溴水的洗气瓶 | |
| C. | 气体通过盛有足量蒸馏水的洗气瓶 | |
| D. | 气体与适量HCl混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com