
五种短周期元素A、B、C、D、E原子序数依次增大,结合下列信息:
(1)A原子核外电子总数是内层电子数的三倍,A、E同主族;
(2)B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H;
(3)C的焰色反应呈黄色;
(4)D在同周期主族元素形成的简单离子中,离子半径最小.回答下列问题:
(1)写出D在元素周期表中的位置: ;
(2)化合物H的水溶液pH 7,其原因是 NH(用离子方程式表示);
(3)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他四种物质发生化学反应,写出该物质的电子式 ;
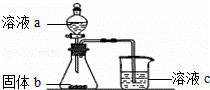
(4)某同学设计实验证明A、B、E的非金属性强弱关系.设计如图装置:
①溶液a和固体b分别为 , ;
②该装置有一个明显不足是 ;若装置改进后溶液c中发生反应的离子方程式为: .
考点: 位置结构性质的相互关系应用.
分析: 五种短周期元素A、B、C、D、E原子序数依次增大,(1)A原子核外电子总数是内层电子数的三倍,则A为碳元素,A、E同主族,则E为硅元素,(2)B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H,则B为氮元素,F为硝酸,G为氨气,H为硝酸铵,(3)C的焰色应呈黄色,则C为钠元素,(4)D在同周期主族元素形成的简单离子中,离子半径最小,且原子序数大于钠,则D为铝元素,据此解答.
解答: 解:五种短周期元素A、B、C、D、E原子序数依次增大,(1)A原子核外电子总数是内层电子数的三倍,则A为碳元素,A、E同主族,则E为硅元素,(2)B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H,则B为氮元素,F为硝酸,G为氨气,H为硝酸铵,(3)C的焰色应呈黄色,则C为钠元素,(4)D在同周期主族元素形成的简单离子中,离子半径最小,且原子序数大于钠,则D为铝元素.
(1)D为铝元素,在元素周期表中处于第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)化合物H为硝酸铵,由于铵根离子水解,它的水溶液呈酸性,所以PH<7,离子方程式为NH4++H2O⇌NH3.H2O+H+,
故答案为:<;NH4++H2O⇌NH3.H2O+H+;
(3)上述元素的最高价氧化物对应的水化物中,氢氧化钠在一定条件下均能与其他四种物质发生化学反应,它的电子式为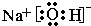 ,故答案为:
,故答案为: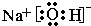 ;
;
(4)①元素的非金属性越强,对应的最高价含氧酸的酸性越强,根据强酸制弱酸的原理设计实验,溶液a和固体b分别为硝酸、碳酸钠或碳酸氢钠,故答案为:硝酸;碳酸氢钠;
②硝酸易挥发,为防止干扰应用碳酸氢钠溶液吸收除去,溶液c为硅酸钠溶液,则溶液c中的离子方程式为:CO2+SiO32﹣+H2O=H2SiO3↓+CO32﹣或2CO2+SiO32﹣+2H2O=H2SiO3↓+2HCO3﹣,
故答案为:没有除去二氧化碳中挥发的硝酸;CO2+SiO32﹣+H2O=H2SiO3↓+CO32﹣或2CO2+SiO32﹣+2H2O=H2SiO3↓+2HCO3﹣.
点评: 本题考查结构性质位置关系、实验方案评价等,侧重于学生的分析能力和实验能力的考查,难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.MnO2+4HCl MnCl2 +Cl2↑+ 2H2O中,氧化剂和还原剂的物质的量之比为1:4
MnCl2 +Cl2↑+ 2H2O中,氧化剂和还原剂的物质的量之比为1:4
B.2H2S+ SO2==3S+2H2O中,氧化产物和还原产物的质量之比为1:1
C.3S+ 6KOH ==2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素的物质的量之比为1:1
D.5NH4NO3==4N2↑+2HNO3+9H2O中,发生氧化反应和发生还原反应的氮元素的质量之比为5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质间的转化关系中不能全部通过一步反应完成的是( )
A. Na→NaOH→Na2CO3→NaCl B. Mg→MgCl2→MgCO3→Mg(OH)2
C. Al→Al2O3→Al(OH)3→AlCl3 D. Fe→FeCl3→Fe(OH)3→Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度最大的是( )
|
| A. | 200mL 2mol/L MgCl2溶液 | B. | 1000mL 2.5mol/L NaCl溶液 |
|
| C. | 250mL 1.5mol/L AlCl3溶液 | D. | 300mL 3mol/LKCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用18 mol·L-1 浓硫酸配制100 mL 3.0 mol·L-1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④
⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是 。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_______________________;
B.容量瓶用蒸馏水洗涤后残留有少量的水________________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
A.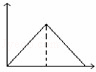 B.
B.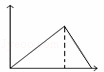 C.
C.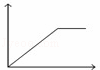 D.
D.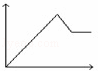
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com