
【题目】下列物质在常温常压下为液体的是( )
A. 甲烷 B. 乙醇 C. 乙烯 D. 乙炔
科目:高中化学 来源: 题型:
【题目】对于反应:2Na2O2 + 2H2O === 4NaOH + O2,下列说法中正确的是 ( )
A. Na2O2是氧化剂,H2O是还原剂
B. Na2O2既是氧化剂,又是还原剂
C. 该反应中电子转移的数目为4e-
D. O2既是氧化产物,又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.所有酯类和糖类都可以发生水解反应
B.分馏石油得到的各个馏分都是混合物
C.棉花和蚕丝的主要成分都是纤维素
D.动物脂肪和植物油都属于酯类,都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: 84消毒液
[有效成分]NaClO
[规格]1000mL
[质量分数]25%
[密度]1.19gcm﹣3
(1)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制80mL含NaClO质量分数为25%的消毒液,需要称量NaClO固体的质量为g;所用到的玻璃仪器有玻璃棒、烧杯、量筒和 .
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm﹣3)的浓硫酸配制2000mL2.3molL﹣1的稀硫酸用于增强“84消毒液”的消毒能力. ①所配制的稀硫酸中,H+的物质的量浓度为molL﹣1 .
②需用浓硫酸的体积为mL.
(4)配置一定物质的量浓度的稀硫酸时,下列操作会使所配溶液物质的量浓度偏低的是 .
A.定容时俯视容量瓶刻度线
B.用量筒量取浓硫酸时俯视刻度线
C.容量瓶用蒸馏水洗涤干净后没有干燥就移入所配置溶液
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线.
E.加水时超过刻度线,用胶头滴管吸出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) ![]() CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) ![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=![]()
B. 反应③的平衡常数K=![]()
C. 对于反应③,恒容时,温度升高,H2的浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2的浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
(1)利用下图装置电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
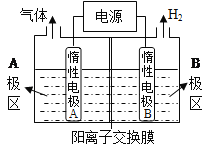
①B极区电解液为____________溶液(填化学式),A极要连接电源的_________(填“正”或“负”)极。
②阳极电极反应式为__________________________________________,电解过程中Na+向____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是________________________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
①若X为碳电极,为减缓铁的腐蚀,开关K应置于________处。(填“A”、“B”或“C”)

②若X为锌电极,开关K置于A处,该电化学防护法称为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2017年08月08日21时19分46秒在四川阿坝州九寨沟县发生7级地震。地震后,为防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等。请回答下列相关问题:
(1)次氯酸盐是一些漂白剂和消毒剂的有效成分。84消毒液的有效成分是次氯酸钠,制取该消毒液的化学方程式为_______。
(2)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在一定条件下与SO2反应制得。该反应的离子方程式为:_______。
(3)漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年,但亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。
当1 molHClO2发生分解反应时,转移电子的物质的量是_________mo1。
Ⅱ.溴及其化合物广泛应用在有机合成、化学分析等领域。
(4)海水提溴过程中溴元素的变化如下:
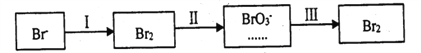
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。调海水PH可提高Cl2的利用率.用平衡原理解释其原因是______________。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
_____Br2+_______Na2CO3 =______NaBrO3+_____CO2+____。
(5)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
粒子 | I2 | Br2 | IO3- |
物质的量/mol | 0.5 | 1.3 |
则原溶液中NaI的物质的量是_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2作为资源再利用是重要的研究课题,工业上用CO2产生燃料甲醇的化学方程式:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
(1)由CO2制备甲醇过程涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3
CH3OH(g) △H3
已知反应Ⅰ、反应Ⅱ、反应Ⅲ的化学平衡常数分别为K1、K2、K3,则K1_______(用K2、K3表示)
(2)一定条件下,在3L恒容密闭容器中充入一定量的H2和CO2,研究反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线如下图所示。
CH3OH(g)+H2O(g) △H1,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线如下图所示。
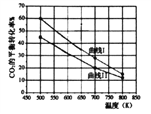
①H2和CO2的起始的投入量以A和B两种方式投入:
A:n(H2)=3mol,n(CO2)=1.5mol,
B:n(H2)=3mol,n(CO2)=2mol
曲线Ⅱ代表______(填“A”或“B”)投入方式反应的△H1________0(填“﹥”或“<”)
②在温度为500K的条件下,充入3molH2和1.5molCO2,该反应5min时达到平衡,此温度下的平衡常数为_______(mol·L-1)-2
③500K时,若在此容器中开始充入0.3molH2和0.9molCO2、0.6molCH3OH、0.6molH2O,则反应向______方向进行(“正反应”或“逆反应”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com