
用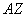 X表示原子:
X表示原子:
(1)中性原子的中子数:N=________。
(2)阳离子的中子数:AXn+共有x个电子,则N=________。
(3)阴离子的中子数:AXn-共有x个电子,则N=________。
(4)中性分子中子数:12C18O2分子中,N=________。
(5)A2-原子核内有x个中子,其质量数为m,则n gA2-所含电子的物质的量为________mol。
(6)某元素的同位素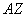 X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,则:
X,其氯化物XCl2。1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,则:
①Z值和A值:Z=________,A=________;
②X元素在周期表中的位置_____________________________。
答案 (1)A-Z (2)A-n-x (3)A-x+n
(4)26 (5)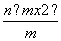 (6)①20 40 ②第四周期第ⅡA族
(6)①20 40 ②第四周期第ⅡA族
解析 (1)根据质量数(A)=质子数(Z)+中子数(N)可求出中子数N=A-Z。
(2)阳离子AXn+有x个电子,说明X原子含有(n+x)个电子,在原子中质子数=核外电子数,则N=A-(n+x)。
(3)阴离子AXn-有x个电子,说明X原子含有(x-n)个电子,则N=A-(x-n)。
(4)12C的中子数为6,18O的中子数为10,12C18O2的中子数为6+10×2=26。
(5)A2-含有的电子数为(m-x+2),ngA2-所含电子数为 (m-x+2)mol。
(m-x+2)mol。
(6)由题意可写出反应方程式:XCl2+2AgNO3===2AgCl↓+X(NO3)2反应消耗的AgNO3物质的量为1 mol/L×0.02 L=0.02 mol,根据反应方程式可推出XCl2的物质的量为0.01 mol,则M(XCl2)=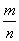 =
=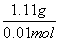 =111 g/mol,则XCl2的式量为111,X的相对原子质量为111-2×36.5=40,则X的质量数为40,质子数为40-20=20,为钙元素,在元素周期表中的位置为第四周期,ⅡA族。
=111 g/mol,则XCl2的式量为111,X的相对原子质量为111-2×36.5=40,则X的质量数为40,质子数为40-20=20,为钙元素,在元素周期表中的位置为第四周期,ⅡA族。


科目:高中化学 来源: 题型:
下列各组元素性质递变情况错误的是( )
A.H、Be、B原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次升高
C. B、C、N、O、F原子半径依次增大
D. Li、Na、K、Rb的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数,下列说法中正确的是( )
①氯元素的相对原子质量一定是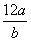 ②m g该氯原子的物质的量一定是
②m g该氯原子的物质的量一定是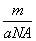 mol ③该氯原子的摩尔质量是aNA g/mol ④a g该氯原子所含质子数是17 mol
mol ③该氯原子的摩尔质量是aNA g/mol ④a g该氯原子所含质子数是17 mol
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作过程能引起实验结果偏高的是( )
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗
②用量筒量取5.0 mL溶液时,俯视读数
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线
④质量分数为10%和90%的两种硫酸等体积混合配制50%的硫酸溶液
A.①③ B.①④
C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲烷的分子个数为1.204×1023,则甲烷的物质的量为 mol,所含的原子个数共有 个,与这些甲烷质量相等的O2的物质的量为 mol。
(2)含有相同氧原子数目的NO和CO2两种气体,其质量比 ,物质的量比为 ,在标准状态下,体积比为 。
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol。
①原NaOH溶液的质量分数为 。
②所得溶液中Cl-的物质的量为 mol。
③所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)⇌ CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动;②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高;③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动;④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高;③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动;④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A.①④ B.①②③ C.②③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com