
NH3是工业生产中的重要化工原料,也是高中化学非常重要的化合物,高考的热点内容.
(1)请写出实验室制取NH3的化学方程式 Ca(OH)2+2NH4Cl  CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)为了快速得到大量的NH3,可通过浓氨水和固体氧化钙作用获得,分析其中的原因 氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣氧化钙溶水产生大量OH﹣,使平衡逆向进行有利于NH3放出.同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出.
多余 (用离子方程式和简要的文字说明)
(3)用排空气法收集到的氨气是相同条件下氢气密度的10.5倍,用此氨气做喷泉实验,液体上升到容器容积的  ,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
(4)科学家利用氨气在纯氧中燃烧,可生成N2和水的原理.设计成NH3﹣O2燃料电池,碱性条件下该电池负极电极反应为: 2NH3+6OH﹣﹣6e﹣=N2+6H2O .
| 氨的化学性质. | |
| 专题: | 氮族元素. |
| 分析: | (1)实验室通常用加热氢氧化钙与氯化铵的混合固体的方法制取氨气,在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水; (2)根据氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣ 氧化钙溶水产生大量OH﹣,使平衡逆向进行有利于NH3放出分析; (3)溶液上升体积等于氨气的体积,根据相对氢气的密度计算集气瓶内气体的平均相对分子质量,进而计算氨气的体积分数; 氨气溶于水,氨气的体积等于溶液体积,令氨气为1mol,则溶液体积为22.4L,再根据c= (4)依据化学方程式分析氨气化合价变化,判断发生氧化反应的物质是氨气,原电池中在负极失电子. |
| 解答: | 解:(1)氨盐和碱反应生成氨气和水,实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,反应的化学方程式为Ca(OH)2+2NH4Cl 故答案为:Ca(OH)2+2NH4Cl (2)因为氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣ 氧化钙溶水产生大量OH﹣,使平衡逆向进行有利于NH3放出,同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出,所以可通过浓氨水和固体氧化钙作用获得氨气; 故答案为:氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣ 氧化钙溶水产生大量OH﹣,使平衡逆向进行有利于NH3放出,同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出; (3)集气瓶内气体的平均相对分子质量=10.5×2=21,令氨气的体积分数为x,则空气的体积分数为(1﹣x),故17x+29(1﹣x)=21,解得x= 令氨气为1mol,则氨气的体积=1mol×22.4L/mol=22.4L, 氨气完全溶于水,溶液的体积等于氨气的体积,即溶液体积为22.4L,所以溶液浓度为 故答案为: (4)电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH﹣﹣6e﹣=N2+6H2O,故答案为:2NH3+6OH﹣﹣6e﹣=N2+6H2O; |
| 点评: | 本题考查氨气的制备方法、喷泉实验的原理、原电池负极方程式的书写及其物质的量浓度有关计算,注意对公式的理解与灵活应用,难度不大. |


科目:高中化学 来源: 题型:
下列说法正确的是
A.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行
B.吸热反应能自发进行的原因是从外界获得了能量
C.SiO2常温下可以与NaOH溶液和HF溶液反应,说明其具有两性
D.反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
|
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将Na2CO3和NaHCO3混合物〔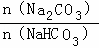 =a a≤3〕溶于水制得稀溶液,下列有关该溶液中微粒的物质的量浓度关系正确的是( )
=a a≤3〕溶于水制得稀溶液,下列有关该溶液中微粒的物质的量浓度关系正确的是( )
|
| A. | a=1则c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+) |
|
| B. | a=2则c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3) |
|
| C. | a为任意值时,则c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣) |
|
| D. | a=0则c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列设备工作时,将化学能转化为热能的是( )
| A | B | C | D |
|
|
|
|
|
| 硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不正确的是( )
|
| A. | 某特定反应的平衡常数仅是温度的函数 |
|
| B. | 催化剂不能改变平衡常数的大小 |
|
| C. | 平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
|
| D. | 化学平衡发生移动,平衡常数必发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知钡的某种同位素是 Ba,由学过的知识无法推断出的信息是( )
Ba,由学过的知识无法推断出的信息是( )
|
| A. | 钡原子的核外电子排布 | B. | 钡元素在周期表中的位置 |
|
| C. | 钡原子的核电荷数 | D. | 钡元素的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质:①聚丙烯酸甲酯;②苯乙烯;③聚乙烯;④二氧化硫;⑤环戊烯;⑥油酸;⑦邻二甲苯;⑧1,3—丁二烯。其中能使酸性KMnO4溶液褪色,也能与溴水发生化学反应而褪色的是( )
A.②⑤⑧ B.③⑤⑦⑧
C.①⑤⑧ D.②④⑤⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com