
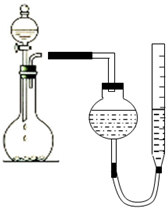
 某学生用图所示的装置测定镁的相对原子质量:
某学生用图所示的装置测定镁的相对原子质量:分析 (1)在装置中注入一定量的水,如果气密性良好,则上下移动量气管,使两边形成液面高度差;
(2)根据1molMg能生成1mol氢气来计算;
(3)读数时应保持气体的压强与外界相同;
(4)设出镁的摩尔质量为Mg/mol,根据收集到的氢气的体积计算出镁的物质的量,然后根据M=$\frac{m}{n}$来计算.
解答 解:(1)在装置中注入一定量的水,如果气密性良好,则上下移动量气管,使两边形成液面高度差,静置后,液面高度不变,
故答案为:在装置中注入一定量的水,如果气密性良好,则上下移动量气管,使两边形成液面高度差;
(2)由于量气管的最大测量体积为50mL,故所生成的氢气的最大体积为50mL,物质的量n=$\frac{0.05L}{22.4L/mol}$=$\frac{5}{2240}$mol,而1molMg能生成1mol氢气,故需要的镁的物质的量n=
$\frac{5}{2240}$mol,质量m=nM=×24g/mol=0.053g,故答案为:0.053;
(3)读数时应让气体恢复至原温度、且保持气体的压强与外界相同,故应使量气管与漏斗中的液面保持在同一水平,故答案为:调节量气管,使量气管与漏斗中的液面保持在同一水平;
(4)设镁的摩尔质量为Mg/mol,收集到的氢气的体积为48.00mL,故氢气的物质的量n=$\frac{0.048L}{22.4L/mol}$=$\frac{48}{2240}$mol,而由于1mol镁生成1mol氢气,故镁的物质的量为
$\frac{48}{2240}$mol,则镁的摩尔质量M=$\frac{m}{n}$=$\frac{0.051g}{\frac{48}{2240}mol}$=23.80g/mol,而一种物质的摩尔质量在数值上等于该物质的相对原子质量,故镁的相对原子质量为23.80,比正确值偏小,原因可能是装置气密性不良,可能漏气或镁条的氧化膜去除不尽,故答案为:23.80;装置气密性不良,可能漏气或镁条的氧化膜去除不尽.
点评 本题考查了相对原子质量的测定,应注意的是在读取气体体积时,应使气体的压强和外界压强一致.


科目:高中化学 来源: 题型:选择题
| 序号 | X | Y | Z | W |  |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A. | ①②③ | B. | ①③④ | C. | ②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属与非金属分界处寻找半导体材料 | |
| B. | 在周期表的左上方区域开发新核能 | |
| C. | 在右上方活泼非金属区域寻找新药物 | |
| D. | 在过渡元素区域寻找催化剂和耐高温、耐腐蚀的新材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
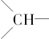 ),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )| A. | 4、6 | B. | 2、3 | C. | 3、6 | D. | 3、3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中不含共价键 | |
| B. | 共价化合物中不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性键不是化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的质量分数相等 | B. | c(NH3)保持不变 | ||
| C. | 各物质的浓度相等 | D. | c(N2):c(H2):c(NH3)=1:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com