
| A. | 三种金属产生氢气的量相同 | |
| B. | 钠反应生成的氢气的量最多 | |
| C. | 铝反应产生的氢气的量最多 | |
| D. | 钠、镁与酸反应生成的氢气的量相同 |
分析 200mL2mol/L的盐酸中含有氯化氢的物质的量为:2mol/L×0.2L=0.4mol,钠可与水反应,盐酸不足,Mg、Al生成氢气相当,但小于钠与水反应生成的氢气,以此进行解答.
解答 解:Na、Mg、Al各1mol,n(HCl)=0.2L×2mol/L=0.4mol,根据关系式2Na~2HCl~H2,Mg~2HCl~H2,2Al~6HCl~3H2可知盐酸完全反应,Mg、Al生成氢气为0.2mol,过量钠和水反应,1mol钠可生成0.5mol氢气,
镁铝产生的氢气一样多,则钠生成氢气最多,
故选B.
点评 本题考查常见金属单质及其化合物性质,题目难度中等,注意掌握常见金属单质的性质,明确钠和水反应的特点,根据物质的量的大小可与酸、水反应的特点比较生成氢气的多少.


科目:高中化学 来源: 题型:解答题
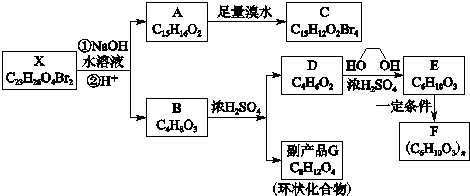
 .写出E→F反应的化学方程式
.写出E→F反应的化学方程式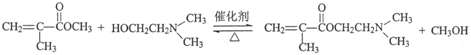 .
.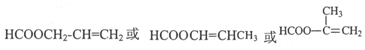 .
.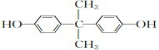 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
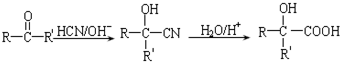
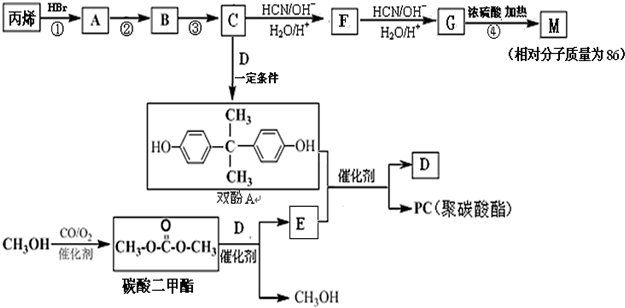
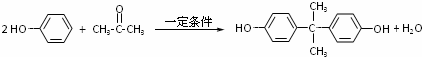 .
.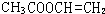 、
、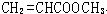 、
、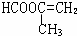 .
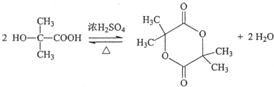
.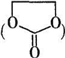 能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式
能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式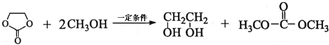
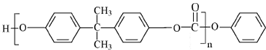 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减少 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、MnO4-、SO42- | B. | Na+、K+、AlO2-、NO3- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Na+、Cu2+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和数滴较浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气在光照下反应只生成一氯乙烷 | |
| B. | 苯在合适条件下催化加氢可生成环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com