
| A、26g | B、36g |
| C、104g | D、130g |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 70g×70% |
| 98g/mol |
| 50g×20% |
| 40g/mol |
| 3 |
| 0.25 |
| 4 |
| n(氢氧化铝) |
| 1 |
| 3 |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、工厂里采用静电除尘,是利用了胶体电泳的性质 |
| B、根据物质在水中或熔融状态下是否导电,可将其分为电解质和非电解质 |
| C、分析和实验也是研究物质性质的方法 |
| D、电解质在水溶液中的反应实质是离子间的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰和干冰既是纯净物又是化合物 |
| B、CuSO4?5H2O属于纯净物 |
| C、纯碱和熟石灰都是碱 |
| D、豆浆和雾都是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
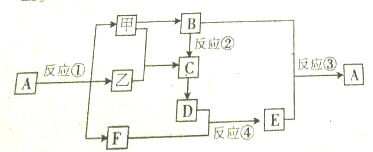
查看答案和解析>>
科目:高中化学 来源: 题型:
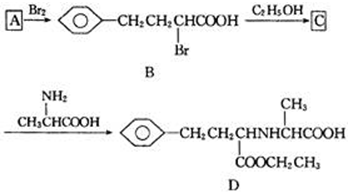
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水中含有溴元素,需经过化学变化才可以得到溴单质 | ||||||||
| B、无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 | ||||||||
| C、从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 | ||||||||
D、从海水中提取镁可以采用下列方法:海水海水
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
| ④ |
| CoSO4溶液 |
| ④ |
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质A的转化率为a | ||
B、起始时刻和达到平衡时容器中的压强比为(1+n):(1+n-
| ||
| C、反应达平衡后,再向容器中充入amolHe,物质B的转化率减小 | ||
| D、当v正(A)=2v逆(C)时,可判断反应达到平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com