
| A. | ①⑦ | B. | ②④ | C. | ③⑤⑥ | D. | ②④⑤⑥ |
分析 由元素的化合价可知,处于最高价的元素的微粒具有氧化性,处于最低价的元素的微粒具有还原性,而处于中间价态的微粒既有氧化性又有还原性,以此来解答.
解答 解:①S2-处于元素最低价,具有还原性;②Fe2+处于元素的中间价,既具有氧化性也具有还原性;③Fe3+处于元素的最高价,只具有氧化性;④S处于元素的中间价,既具有氧化性也具有还原性; ⑤H+处于元素的最高价,只具有氧化性;⑥Cu2+处于元素的最高价,只具有氧化性;⑦Mg处于元素的最低价,只具有还原性,
故选C.
点评 本题考查氧化还原反应及微粒的性质,为高频考点,明确氧化性、还原性与微粒中元素的化合价的关系是解答本题的关键,题目难度不大.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
实验中的下列操作正确的是
A. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水池中,再用水冲入下水道
C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部蒸干
D. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由热电站提供电力电解水产生氢 | |
| B. | 用铁和盐酸反应放出氢气 | |
| C. | 利用太阳能在一定条件下使水分解产生氢气 | |
| D. | 以焦炭和水制取水煤气(含CO和H2)后分离出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO3+H2O═H2SO4 | ||
| C. | 2F2+2H2O═4HF+O2↑ | D. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KHSO4 | B. | Cu2(OH)2CO3 | C. | Ca(H2PO4)2 | D. | NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧根离子的电子式是 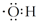 | |
| B. | 二氧化碳分子的比例模型是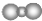 | |
| C. | 芳香烃的组成通式是CnH2n-6(n≥6) | |
| D. | 12C和14C的原子结构示意图均可表示为 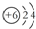 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com