
如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
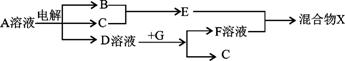
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 。
④写出过量的E与F溶液中溶质反应的离子方程式 。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
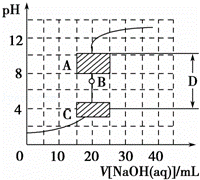
滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.
强酸强碱中和滴定是一种准确度很高的定量分析的实验方法,其最主要的原因是:强酸强碱中和反应进行的很彻底,且在滴定过程中锥形瓶中混合溶液的pH变化通常如图所示,图中的点B称为 ,D区域称为 ,酸碱恰好中和时溶液的pH落在图中A段范围,则应选用的指示剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)下列说法正确的是
A. 向乙中加入适量盐酸,溶液组成可以恢复
B. 电解时向乙滴入酚酞溶液,c电极附近变红
C. 当b极有64gCu析出时,c电极产生2g气体
D.甲中a极上的电极反应为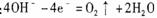
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-Q kJ·mol-1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1 mol SO3固体放热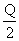 kJ
kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是
A.H、D、T互为同位素
B.NaHCO3、HCOONa均含有离子键和共价键
C.常温常压下,22.4 L CCl4含有NA个CCl4分子
D.常温下,23 g NO2含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.元素的原子序数越大,其族序数也越大
B.同周期的第ⅡA族与第ⅢA族的原子序数一定相差1
C.在元素周期表中,第14列元素所形成的化合物种类最多
D.元素的最外层电子数为奇数,其族序数不一定为奇数
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应的热化学方程式:
(1)N2(g)与H2(g)反应生成1 mol NH3(g),放出46.1 kJ热量________。
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是( )
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子的半径越小,还原性越强
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com