
| 电离能kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
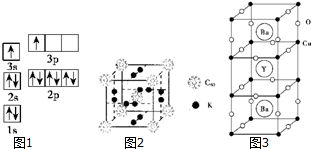
分析 (1)①根据A、B两原子的第二、三电离能之间都有1个突跃,它们都是短周期元素推知元素A和元素B;根据核外电子排布所遵循的原理找出电子排布图的错误,
②根据价层电子对互斥理论,求出价层电子对数,得出分子构型及原子的杂化类型;
(2)①根据分子晶体的熔点与共价键的键能无关;
②根据晶胞的分配原则计算出每个晶胞结构各离子的个数,根据晶胞的结构图可判断晶胞中每个C60分子周围与之等距离且最近的C60分子数;
③根据同一周期,同一主族,元素电负性变化规律,比较元素电负性大小;根据每个硅原子最外层才满足8电子稳定结构,得出每个硅原子只有$\frac{1}{2}$个π键;
(3)①利用均摊法计算晶胞的结构;
②利用化合价代数和为0计算;
③根据晶胞结构图判断配位数.
解答 解:(1)①表中A、B两原子的第二、三电离能之间都有1个突跃,说明它们属于ⅡA族,又它们都是短周期元素,且A的第一电离能比B大,因此,A为Be元素,B为Mg元素,图1所示电子排布,根据能量最低原理,最外层两个电子应全排在s轨道上,
故答案:能量最低原理;
②A和氯元素形成的简单分子为BeCl2,根据价层电子对互斥理论 n=$\frac{2+1×2}{2}$=2,分子构型为直线形,Be原子按sp方式杂化,
故答案:直线形;sp;
(2)①尽管C60中C-C键的键能可能大于金刚石,但其熔化时并不破坏化学键,因此比较键能没有意义,
故答案:不正确;因为C60构成的晶体是分子晶体,影响分子晶体熔点的作用是分子间作用力;而金刚石构成的晶体是原子晶体,影响原子晶体熔点的作用是原子间共价键,共价键作用大大与分子间作用力,因此金刚石的熔点高于C60;
②在晶胞中,K原子在面心上和C60分子在顶点和中心,则其个数比为$\frac{12×\frac{1}{2}}{8×\frac{1}{8}+1}$=3:1,根据晶胞的结构图可知,以晶胞顶点上的C60为例,C60分子周围与之等距离且最近的C60分子位于晶胞相邻的顶点,共有6个,
故答案:3:1;6;
③同一周期,从左到右,电负性逐渐增大,同一主族,从上到下,电负性逐渐减小,因此,原子电负性由大到小的顺序是:N>C>Si,根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构.显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30.
故答案:N>C>Si;30;
(3)①结合晶胞图再根据均摊法可知,在一个晶胞中含有Y原子数为1,Cu原子数为8×$\frac{1}{4}$+8×$\frac{1}{8}$=3,Ba原子数为2,O原子数为的个数为8×$\frac{1}{2}$+12×$\frac{1}{4}$=7,所以Y、Cu、Ba和O的个数比为1:3:2:7,所以化学式为YBa2Cu3O7;
故答案为:YBa2Cu3O7;
②根据化合价代数和为0可知,Cu的平均化合价为+$\frac{2×7-3-2×2}{3}$=+$\frac{7}{3}$,
设晶胞平均含有x个Cu2+,ygCu3+,
则有:$\left\{\begin{array}{l}{x+y=3}\\{2x+3y=2×7-3-2×2}\end{array}\right.$,解之得x=2,y=1,
所以:Cu2+:Cu3+=2:1.
故答案为:Cu2+:Cu3+=2:1;
③根据晶胞结构图可知,Ba2+的周围距离最近的氧原子有10个,所以Ba2+的配位数为10,
故答案为:10.
点评 本题主要考查了电离能、电负性、电子排布图、分子的空间构型、晶胞的计算等,试题涉及的知识点较多,侧重于物质结构知识的综合考查,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | R的原子半径比Z的大 | |
| B. | X与Y形成的化合物只有一种 | |
| C. | W的简单气态氢化物的稳定性比R的弱 | |
| D. | Y的最高价氧化物对应水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol•L-1•min-1 | B. | 2mol•L-1•min-1 | ||
| C. | 5mol•L-1•min-1 | D. | 10mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4•10H2O脱水是吸热过程 | |
| B. | 铵盐发生了复分解反应,且为吸热反应 | |
| C. | NH4NO3溶于水会吸收热量 | |
| D. | 较长时间制冷是由于Na2SO4•10H2O脱水过程较慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 反应N2O4(g)?2NO2(g);△H=+57kJ•mol-l,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法不正确的是( )
反应N2O4(g)?2NO2(g);△H=+57kJ•mol-l,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法不正确的是( )| A. | A、C两点气体的平均相对分子质量:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | 由状态B到状态A,可以用加热的方法 | |
| D. | A、C两点的反应速率:A<C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
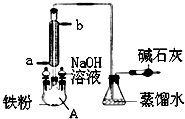
| A. | 仪器A左上侧的分液漏斗中加入的是苯和溴水 | |
| B. | 仪器A的名称叫蒸馏烧瓶 | |
| C. | NaOH溶液的主要作用是除去反应后溶解在溴苯中的溴 | |
| D. | 碱石灰作用是防止空气中水蒸气进入反应体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取浓盐酸时仰视读数 | |
| B. | 溶解搅拌时有液体飞溅 | |
| C. | 定容时仰视容量瓶瓶颈刻度线 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成C的速率与C分解的速率相等 | |
| B. | A、B、C的浓度相等 | |
| C. | 单位时间生成n molA,同时生成3n molB | |
| D. | A、B、C的分子数之比为1:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com