
 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( )| X | Y | Z | 实验现象 | |
| A | 苯酚浑浊液 | NaOH溶液 | 盐酸 | 浑浊液变澄清,后又变浑浊 |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 溶液变为红色,后颜色加深 |
| C | KI溶液 | 足量氯水 | 乙醇 | 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
| D | Na2SO3溶液 | Ba(NO3)2溶液 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
| A、A | B、B | C、C | D、D |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )
如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )| A、a、b不可能是同种材料的电极 |
| B、该装置可能是原电池,电解质溶液为稀盐酸 |
| C、该装置可能是a、b未形成闭合回路,电解质溶液是稀硝酸 |
| D、该装置可能是电解池,电解质溶液为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
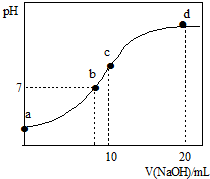 常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L NO和22.4L O2的混合,混合气体中含有的氧原子数为3NA | ||||
| B、0.012kg 13C中,含中子数为7NA | ||||
| C、25℃时,1L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子 | ||||
D、在反应3SiO2+6C+2N2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用坩埚灼烧MgCl2?6H2O的化学反应方程式:MgCl2?6H2O
| ||||
| B、KSCN和FeCl3混合液存在着平衡:3KSCN+FeCl3?Fe(SCN)3+3KCl,加入少量KCl固体后溶液颜色不发生变化 | ||||
| C、常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一 | ||||
D、 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)?c(SO42-).则加入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d点变到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B两元素能形成多种化合物 |
| B、D、E两元素的最高价氧化物对应的水化物可相互反应 |
| C、C的气态氢化物的稳定性一定大于F的气态氢化物 |
| D、C、F两种元素可以形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、标准状况下,4.48L N2所含的共用电子对数0.2NA |
| D、常温下,1L 0.1mol?L-1的CH3COOH溶液中含有的H+数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com