
将含有杂质的4.0 g的NaOH固体配成1000 mL溶液,取20 mL溶液置于锥形瓶中,用0.1 mol·L-1盐酸滴定(甲基橙作指示剂),消耗盐酸20.4 mL,则该NaOH固体中含有的杂质可能是( )
A.Na2O B.Na2CO3
C.NaHCO3 D.KOH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
关于晶体的叙述中,正确的是( )
A.原子晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔、沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是( )
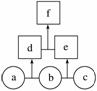
A.常温下,单质a呈气态
B.单质c具有强氧化性
C.稳定性:d>e
D.f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.甲苯和乙烯均可使酸性KMnO4溶液褪色
B.纤维素、淀粉和蛋白质都是高分子化合物
C.煤的干馏和石油的分馏均属化学变化
D.酯类和糖类均能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有6.85 g铅的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到4.00 g 固体沉淀物,这种铅的氧化物的化学式为( )
A.PbO
B.PbO2
C.Pb3O4
D.Pb3O4和PbO2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
通过化学反应原理猜测可能生成哪些物质,对这些物质逐一进行检验来确定究竟含有哪些物质。正确解答此类试题的关键:(1)猜测要全面;(2)熟记常见物质的检验方法。
| [典例] | 审题指导 |
| 某研究性学习小组用下列装置(铁架台等夹持仪器略)探究氧化铁与乙醇的反应,并检验反应产物。 | 联想:乙醇的催化氧化。 |
| (1)用2%的CuSO4溶液和10%的NaOH溶液配制Cu(OH)2悬浊液的注意事项是________________________________________________________________________。 | 新制Cu(OH)2悬浊液与醛基的反应需要碱性条件。 |
| (2)为快速得到乙醇气体,可采用的方法是________________________________________________________________________。 若实验时小试管中的溶液已经开始发生倒吸,可采取的措施是________(填字母)。 a.取下小试管 b.移去酒精 c.将导管从乳胶管中取下 d.以上都可以 | ①升高温度可加速乙醇的挥发。 ②若液体倒吸入加热的反应管,可能会造成反应管炸裂,取下小试管已无济于事,因“溶 液已经开始发生倒吸”。 |
| (3)如图实验,观察到红色的Fe2O3全部变为黑色固体M,充分反应后停止加热。取下小试 管,加热,有砖红色沉淀生成。 为了检验M的组成,进行下列实验。 ①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成; ②经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是_____________________;证明溶液含有亚铁离子的方法是________________________________________________________________________。 能得出的结论是________(填字母)。 a.M中一定有+3价和+2价铁,不能确定是否有0价铁 b.M中一定有+3价和0价铁,无+2价铁 c.M中一定有+3价铁,0价和+2价铁至少有一种 d.M中一定有+3价、+2价和0价铁 | 破题关键 分析黑色固体(M)可能的成分,铁的氧化物Fe3O4、FeO和铁粉均为黑色,Fe3O4中既有+3价铁又有+2价铁,且具有磁性,Fe3+能溶 解单质铁。 易错警示 已知溶液中有Fe3+,检验Fe2+不能用KSCN 溶液。 |
| (4)若M的成分可表达为FexOy,用CO还原法定量测定其化学组成。称取m g M样品进行定量测定,实验装置和步骤如下:
①组装仪器;②点燃酒精灯;③加入试剂;④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧…… 正确的操作顺序是________(填字母)。 a.①⑤④③②⑥⑦⑧ b.①⑤③④②⑥⑦⑧ c.①③⑤④②⑦⑥⑧ d.①③⑤②④⑥⑦⑧ 若M完全被还原后碱石灰增重n g,则 | 破题关键 Ⅰ.检查气密性属于实验的准备阶段,应在加药品前进行。 Ⅱ.类比氢气还原氧化铜。 Ⅲ.碱石灰增加的质量即为反应产生的CO2的质量,得关系式M中n(O)=n(CO2)。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知亚硫酸钠在空气中能被氧气氧化生成硫酸盐。
Ⅰ.甲同学设计两种方案来检验Na2SO3溶液是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠溶液没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠溶液完全变质。
请你对两方案作出评价:
方案一:________(填“合理”或“不合理”),理由是_______________________
________________________________________________________________________。
方案二:________(填“合理”或“不合理”),理由是____________________________
________________________________________________________________________。
Ⅱ.乙同学探究Na2SO3溶液是否发生变质,设计如下实验测定1.0 mol·L-1 Na2SO3溶液的实际浓度。
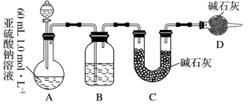
(1)分液漏斗中应加入足量的下列哪种试剂?________(填字母)
a.浓硝酸 b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重3.2 g,则Na2SO3溶液实际的物质的量浓度为________。
(3)该实验装置还存在一个明显的缺陷是________。
答案 Ⅰ.不合理 亚硫酸钠部分变质时滴加盐酸也会产生气泡 不合理 亚硫酸钠也能与氯化钡反应生成白色沉淀,亚硫酸钠未变质或部分变质时也会产生白色沉淀
Ⅱ.(1)b (2)0.83 mol·L-1
(3)缺少一个驱赶残留二氧化硫气体的装置(或其他合理答案)
查看答案和解析>>
科目:高中化学 来源: 题型:
请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱。请写出电极反应式,负极________________________________________________________________________,
正极________________________________________________________________________,
并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路电子流向。
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学反应中,反应前与反应后相比较,肯定不变的是 ( )。
①元素的种类 ②原子的种类 ③分子的数目 ④原子的数目 ⑤反应前物质的质量总和与反应后物质的质量总和 ⑥如果在水溶液中反应,反应前与反应后阳离子所带的正电荷总数
A.①②③④ B.①②⑤⑥
C.①②④⑤ D.②③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com