
分析 ①乙酸乙酯含-COOC-,在酸性条件下可发生水解反应;
②乙酸乙酯与NaOH反应,为水解反应,生成乙酸钠和乙醇,以此来解答.
解答 解:①乙酸乙酯含-COOC-,在酸性条件下可发生水解反应,则第一支试管中稀硫酸的作用是催化剂,
故答案为:催化剂;
②乙酸乙酯与NaOH反应,为水解反应,生成乙酸钠和乙醇,反应为CH3COOCH2CH3+NaOH$\stackrel{H_{2}O}{→}$CH3COONa+CH3CH2OH,
故答案为:CH3COOCH2CH3+NaOH$\stackrel{H_{2}O}{→}$CH3COONa+CH3CH2OH.
点评 本题考查有机物的结构与性质,为高频考点,把握乙酸乙酯的官能团及水解反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +CaCl2+H2O,该反应的原子利用率25.4%.
+CaCl2+H2O,该反应的原子利用率25.4%. ,
, )与乙二醇作用,可生成一系列化合物:
)与乙二醇作用,可生成一系列化合物: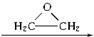 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
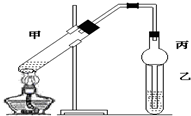
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取100mL5mol/LH2SO4,加入400mL水 | |
| B. | 取200mL5mol/LHCl,加水稀释至500mL | |
| C. | 取200 mL5mol/LH2SO4,加水稀释至500mL | |
| D. | 取100 mL5mol/LHNO3,加水稀释至500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-3 mol•L-1 | 1.00 | 0.25 | 0.16 | 0.10 | 0.10 |
| c(CO)/10-3 mo l•L-1 | 3.60 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 0~2 s间的平均反应速率v(NO)=3.75×10-3mol/(L•s) | |
| B. | 催化转化器对废气的转化速率在冬季时比夏季时高 | |
| C. | 选用更有效的催化剂可以提高污染物的转化率 | |
| D. | 该温度下,此反应的平衡常数K=5.0×103 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com