
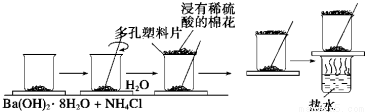
分析 (1)反应为复分解反应,二者反应生成氨气、水、以及氯化钡;该反应属于复分解反应;
(2)玻璃棒的搅拌作用是使混合物混合均,让化学反应快速发生;
(3)根据反应是否充分进行分析;
(4)通过玻璃片上结冰现象可以确定反应是吸热的;吸热反应中,反应物的总能量小于生成物的总能量;
(5)反应生成氨气会污染空气,用硫酸吸收.
解答 解:(1)氯化铵属于铵盐,能和强碱氢氧化钡反应生成氨气、水、以及氯化钡,化学方程式为Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,该反应属于复分解反应;
故答案为:Ba(OH)2•8H2O+2NH4Cl═BaCl2+10H2O+2NH3↑;复分解;
(2)Ba(OH)2•8H2O晶体和氯化铵晶体之间的反应是固体之间的反应,搅拌可使混合物充分接触并发生反应,
故答案为:使反应物充分混合,迅速发生反应,使体系的温度降低;
(3)①反应物未进行快速搅拌;②玻璃片上滴加的水太多;③氢氧化钡晶体已部分失水;④环境温度太高;⑤试剂用量太少;⑥氢氧化钡晶体未研成粉末,可能看不到“结冰”现象,
故答案为:①反应物未进行快速搅拌、②玻璃片上滴加的水太多、③氢氧化钡晶体已部分失水、④环境温度太高、⑤试剂用量太少、⑥氢氧化钡晶体未研成粉末(其他答案合理均正确);
(4)通过玻璃片上结冰现象可以确定温度降低,即反应是吸热的;吸热反应中,反应物的总能量小于生成物的总能量,故答案为:吸;低;
(5)反应生成氨气会污染空气,可以用硫酸吸收,则用浸有稀硫酸的湿棉花置于多孔塑料板上可以吸收反应生成的氨气,防止污染空气,
故答案为:吸收多余的氨气,防止污染空气.
点评 本题考查了化学反应中的能量变化以及吸热反应、放热反应与反应条件的关系.以Ba(OH)2•8H2O与NH4Cl固体的反应为背景考查了分析问题、解决问题的能力和实验设计能力.反应放出或吸收的热量可以通过触觉感知,也可以通过温度计测量,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子中的3个碳原子在一条直线上 | |
| B. | 在光照条件下能和氯气发生取代反应 | |
| C. | 分子中含有极性键和非极性键 | |
| D. | 丙烷和丁烷互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
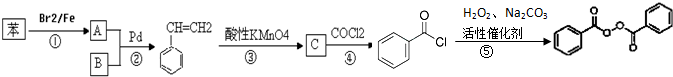
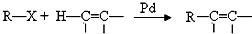
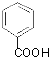 ;
;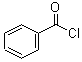 +H2O2$→_{碳酸钠}^{催化剂}$
+H2O2$→_{碳酸钠}^{催化剂}$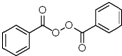 +2HCl;
+2HCl;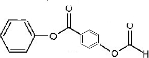 或
或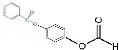 ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.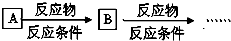
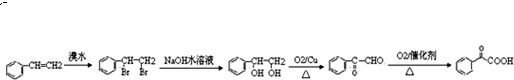 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
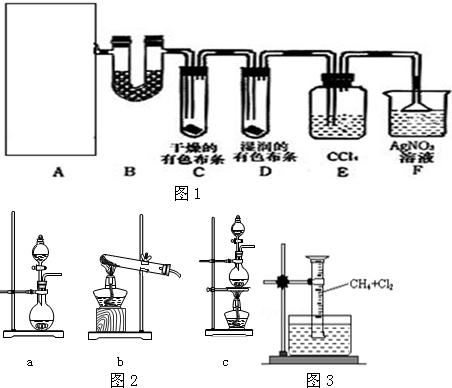
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应一定伴随能量变化 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 放热反应中反应物的总能量大于生成物的总能量 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 二 | ⑪ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
; ;用电子式表示元素②与⑪化合物的形成过程
;用电子式表示元素②与⑪化合物的形成过程 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ②③④⑤⑥⑦⑧ | C. | ②④⑦ | D. | ②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28gCH2=CH2含有NA个碳原子 | |
| B. | 1mol苯含有3NA个碳碳单键和3NA个碳碳双键 | |
| C. | 标准状况下,22.4L正戊烷含有12NA个氢原子 | |
| D. | 常温常压下,16gCH4含有4NA个共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com