
【题目】精细化工在生产和生活中有广泛而重要的应用。
(1)精细化学品往往有特定的功能从而广泛地应用于日常生活中,下列洗涤方法原理各不相同,请比较
①沾有油脂的器皿可用汽油擦洗,其原理是________;
②也可用洗洁精和水洗涤,其原理是_______;
③还可以用纯碱或稀氢氧化钠溶液洗涤,其原理是___________。
④如果水溶液的硬度很大,用肥皂与合成洗涤剂哪个洗涤剂效果更好?为什么? ____。
(2)据报道,我国某地发生误食工业用猪油的中毒事件,原因是工业品包装中混入有机锡等,下列有关叙述正确的是__________。
A.猪油是天然高分子化合物
B.猪油是高级脂肪酸甘油酯
C.猪油发生皂化反应后,反应液能使蓝色石蕊试纸变红
D.猪油皂化反应完全后,反应混合物静置后分为两层
(3)阿司匹林是一种常用的药剂,其化学名称为乙酰水杨酸,其分子结构如图:
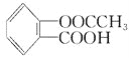
阿司匹林的一种同分异构体中含有苯环和两个羧基,且苯环上只有一个侧链,则阿司匹林的这种同分异构体的结构简式为____________。以苯酚为原料合成水杨酸,为阿司匹林的大量生产开辟了广阔的前景,其生产阿司匹林的流程如下:
![]()
![]()
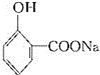
![]() 水杨酸
水杨酸![]() 阿司匹林
阿司匹林
写出反应②的化学方程式__________。
【答案】根据相似相溶原理,汽油与油脂互溶除去 洗洁精属于合成洗涤剂,含有亲水基和憎水基,可将油污洗去 油脂在碱性条件下发生水解,从而用纯碱或稀氢氧化钠溶液可以除去油脂 用合成洗涤剂较好,因为在硬水中肥皂会形成硬脂酸钙(镁)沉淀而失去去污能力 B 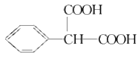
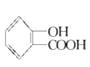 +(CH3CO)2O→
+(CH3CO)2O→ +CH3COOH
+CH3COOH
【解析】
(1)①根据相似相溶回答;②洗洁精具有亲水基,和憎水基,可以将油污除去;③油脂在碱性环境下水解;④硬水中使用肥皂,会产生沉淀,降低去污能力。
(3)苯酚,与NaOH和CO2,在一定条件下,发生反应,在酚羟基的邻位引入一个—COONa,酸化得到—COOH,在乙酸酐的作用下,酚羟基转化为酯基。
(1)①根据相似相溶原子,油脂能够溶解在汽油中,因此能够用汽油去油脂;
②洗洁精属于合成洗涤剂,含有亲水基和憎水基,憎水基与油污结合,亲水基溶于水中,形成乳浊液,可将油污洗去;
③油脂在碱性条件下发生水解,从而用纯碱或稀氢氧化钠溶液可以除去油脂;
④用合成洗涤剂较好,因为在硬水中肥皂会形成硬脂酸钙(镁)沉淀而失去去污能力;
(2)A、猪油是脂肪,是高级脂肪酸的甘油酯,不是高分子化合物,故A错误;
B、猪油是固态油脂,成分为高级脂肪酸甘油酯,故B正确;
C、皂化反应水解后生成的高级脂肪酸钠和甘油,不显示酸性,所以不能是石蕊变红,故C错误;
D、由于猪油皂化反应后,生成的高级脂肪酸钠和甘油都溶于水,不分层,故D错误;
故选:B;
(3)阿司匹林的同分异构体含有苯环和两个羧基,且苯环上只有一个侧链,除了苯环外,还有3个C原子,还有2个羧基,只有1个侧链,则一个C上连接2个苯环,结构简式为 ;
;
苯酚,与NaOH和CO2,在一定条件下,发生反应,在酚羟基的邻位引入一个—COONa,酸化得到—COOH,水杨酸的结构简式为 ,在乙酸酐的作用下,酚羟基转化为酯基,化学方程式为
,在乙酸酐的作用下,酚羟基转化为酯基,化学方程式为 +(CH3CO)2O→
+(CH3CO)2O→ +CH3COOH。
+CH3COOH。


科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下:

下列说法不正确的是
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.元素乙的简单气态氢化物的稳定性强于CH4
C.原子半径比较:甲>乙>Si
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下实验方案中,可以达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 分离乙醇和水 | 将锌板换成铜板 对钢闸门保护效果更好 | 已知:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓ 验证非金属性:C > Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产、科研密切相关,请根据所学知识回答:
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为____。
(2)B为0.1mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:___。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入___,目的是___;
(4)若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:将Fe3+转化为Fe2+
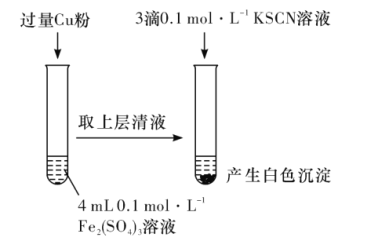
(1)Fe3+与Cu粉发生反应的离子方程式为__。
(2)探究白色沉淀产生的原因,请填写实验方案:__、__。
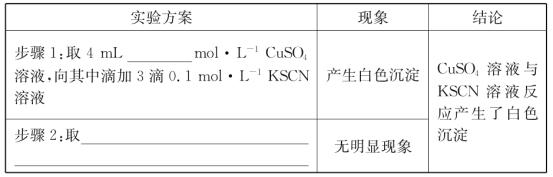
查阅资料:
已知:①SCN-的化学性质与I-相似。
②2Cu2++4I-=2CuI↓十I2。
则Cu2+与SCN-反应的离子方程式为__。
实验II:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因:__。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应,
反应II:Fe2+与NO反应。
①依据实验现象,可推知反应I的速率比反应II__(填“快"或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明___。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A. △H4=2/3(△H1+△H2-3△H3)
B. △H4=2/3(3△H3-△H1-△H2)
C. △H4=3/2(△H1+△H2-3△H3)
D. △H4=3/2(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统硅酸盐材料因其耐高温、抗腐蚀、强度高等优异性能,被广泛应用于各种工业、科学研究及日常生活中。某硅酸盐材料的主要成分为氧化钙、二氧化硅,并含有一定量铁、铝及镁的氧化物,某研究小组设计以下流程测定该硅酸盐材料中钙的含量(如下图所示)。
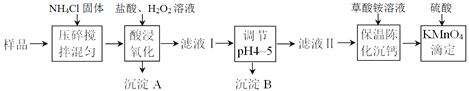
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度以0.1mol·L-1计)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Ca(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 12.3 | 4.0 | 8.0 |
完全沉淀pH | 3.7 | 9.6 | 14.3 | 5.2 | 12.4 |
回答下列问题:
(1)酸浸后,加入双氧水所发生反应的离子方程式为_________________。为提高钙的浸出率,可以采取的措施是________________________。(任写一种)
(2)沉淀B的成份为_____________。调节滤液Ⅰ的pH为4~5,加入的物质可以是_________。
A. CaCO3 B. Ca(OH)2 C. 氨水 D. MgO
(3)向滤液Ⅱ中加足量草酸铵溶液,在水浴上保温陈化2小时,冷却到室温,过滤、洗涤沉淀。将得到的CaC2O4沉淀溶解在硫酸中,并稀释配成250mL溶液。用移液管量取25.00 mL溶液于锥形瓶中,用KMnO4标准溶液滴定。滴定时发生反应的离子方程式为___________________________。若实验中所取样品质量为4.00 g ,KMnO4标准溶液浓度为0.0500 mol/L,平行滴定3次用去KMnO4标准溶液体积平均值为36.00 mL,则该硅酸盐样品中钙的质量分数为_________。
(4)在保温沉钙环节,若样品中镁的含量过高,会导致最终测定结果产生较大误差。试从理论上计算,加草酸铵溶液沉钙时,溶液中镁离子的浓度最高不能超过____mol/L。(已知:Ksp(CaC2O4) = 4.00×10-9,Ksp(MgC2O4) = 4.83×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池(俗称干电池)在生活中的用量很大。其中普通锌锰电池的构造图如右图所示。回答下列问题:
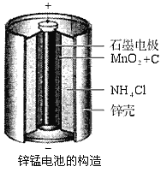
(1)电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,正极发生的主要反应是________________________。
(2)下图表示从废旧普通锌锰电池除去锌壳和电极后的内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。

①黑色固体混合物水浸时为提高浸出速率,常采用的措施为________________(答两条);得到滤液加入稀盐酸的作用为__________________。
②滤渣水洗灼烧后固体主要成份只有一种,操作a中得到熔块的主要成分是K2MnO4,该过程中发生反应的化学方程式为:_____________________________。
③图中产物的化学式分别为:A__________、B_________。
(3)准确称量得到的KMnO4(不含能与草酸反应的杂质)3.160 g,放入小烧杯中,加水溶解后转移到200mL容量瓶中定容,在锥形瓶中用差量法称取0.6700 g无水草酸钠,加入足量硫酸溶液溶解,加热至75~80℃。用已配制好的KMnO4溶液进行滴定,消耗溶液体积为22.50mL。
已知Mr(Na2C2O4)=134 Mr(KMnO4)=158
①判断滴定终点的现象是__________________。
②KMnO4的纯度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com