
| A. | Li | B. | S | C. | Si | D. | P |
分析 第三周期R元素的原子的次外层的电子数为最外层电子数的2倍,最外层不大于8个电子,次外层不大于18个电子,以此进行判断.
解答 解:A.Li原子核外各层电子分别为2、1,次外层的电子数为最外层电子数的2倍,但属于第二周期,故A错误;
B.S原子核外各层电子分别为2、8、6,次外层的电子数不为最外层电子数的2倍,故B错误;
C.Si原子核外各层电子分别为2、8、4,次外层的电子数为最外层电子数的2倍,属于第三周期,故C正确;
D.P原子核外各层电子分别为2、8、5,次外层的电子数不为最外层电子数的2倍,故D错误.
故选C.
点评 本题考查了原子核外电子的排布,难度不大,注意原子核外电子的排布时,每个电子层上最多排2n2个电子,但必须遵循“最外层不大于8个电子,次外层不大于18个电子,”的规则.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8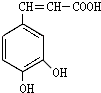 ),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.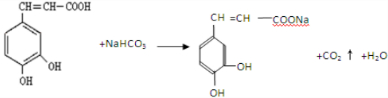 .
. ,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为
,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n+3 | B. | n-4 | C. | n-6 | D. | n-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有沉淀产生 | 蛋白质均发生变性 |
| D | 向某溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | R |
| W |
| A. | Z的氧化物与X单质不可能发生置换反应 | |
| B. | 五种元素的原子最外层电子数一定都大于2 | |
| C. | X、Z原子序数可能相差18 | |
| D. | Z可能是氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
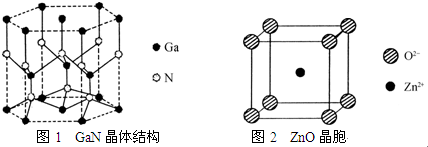
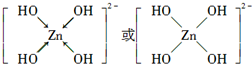 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com