
分析 (1)①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1
②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ•mol-1
将方程式$\frac{①+②}{3}$得Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H 进行相应的改变;
(2)KSP(BaSO4)=1.1×1010,假设两种溶液的体积都是1L,n[Ba(OH)2]=0.1mol/L×1L=0.1mol<n(H2SO4)=0.12mol/L×1L=0.12mol,所以硫酸剩余,溶液呈酸性,混合溶液中c(SO42- )=$\frac{0.12mol-0.1mol}{2L}$=0.01mol/L,c(Ba2+)=$\frac{{K}_{sp}}{c(S{{O}_{4}}^{2-})}$;
(3)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
②根据图知,二氧化硫的转化率为90%,开始时c(SO2)=$\frac{2.0mol}{5L}$=0.4mol/L、c(O2)=$\frac{1.0mol}{5L}$=0.2mol/L,参加反应的c(SO2)=0.4mol/L×90%=0.36mol/L,
该反应SO2(g)+O2(g)=2SO3(g)
开始(mol/L)0.4 0.2 0
反应(mol/L)0.36 0.18 0.36
平衡(mol/L)0.04 0.02 0.36
化学平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$;
升高温度正逆反应速率都增大,反应到达平衡的时间缩短,升高温度平衡逆向移动,二氧化硫转化率降低;
(4)①若溶液中含铜微粒的总浓度为amol•L-1,则X点对应的c(CuCl+)=amol/L×(1-22%-22%);
②根据图知,氯离子浓度减小,含铜微粒有CuCl+变为Cu 2+.
解答 解:(1)①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1
②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ•mol-1
将方程式$\frac{①+②}{3}$得Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=$\frac{-768.2+116.0}{3}$kJ/mol=-217.4kJ/mol,
故答案为:-217.4kJ/mol;
(2)KSP(BaSO4)=1.1×1010,假设两种溶液的体积都是1L,n[Ba(OH)2]=0.1mol/L×1L=0.1mol<n(H2SO4)=0.12mol/L×1L=0.12mol,所以硫酸剩余,溶液呈酸性,混合溶液中c(SO42- )=$\frac{0.12mol-0.1mol}{2L}$=0.01mol/L,c(Ba2+)=$\frac{{K}_{sp}}{c(S{{O}_{4}}^{2-})}$=$\frac{1.1×1{0}^{-10}}{0.01}$mol/L=1.1×10-8 mol/L,
故答案为:1.1×10-8 mol/L;
(3)①A.反应前后气体总质量不变、容器体积不变,所以容器内气体密度始终不变,不能据此判断平衡状态,故错误;
B.无论反应是否达到平衡状态都存在O2、SO2的消耗速率之比为1:2,不能据此判断平衡状态,故错误;
C.n(SO2):n(O2):n(SO3)=2:1:2 时该反应不一定达到平衡状态,与反应初始浓度及转化率有关,不能据此判断平衡状态,故错误;
D.反应前后气体物质的量减小、压强减小,当容器内压强不再发生变化时正逆反应速率相等反应达到平衡状态,故正确;
故选D;
②根据图知,二氧化硫的转化率为90%,开始时c(SO2)=$\frac{2.0mol}{5L}$=0.4mol/L、c(O2)=$\frac{1.0mol}{5L}$=0.2mol/L,参加反应的c(SO2)=0.4mol/L×90%=0.36mol/L,
该反应SO2(g)+O2(g)=2SO3(g)
开始(mol/L)0.4 0.2 0
反应(mol/L)0.36 0.18 0.36
平衡(mol/L)0.04 0.02 0.36
化学平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$=$\frac{0.3{6}^{2}}{0.0{4}^{2}×0.02}$=4050;
升高温度正逆反应速率都增大,反应到达平衡的时间缩短,升高温度平衡逆向移动,二氧化硫转化率降低,其图象为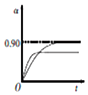 ,
,
故答案为:4050; ;
;
(4)①若溶液中含铜微粒的总浓度为amol•L-1,则X点对应的c(CuCl+)=amol/L×(1-22%-22%)=0.56amo/L,
故答案为:0.56amol/L;
②根据图知,氯离子浓度减小,含铜微粒有CuCl+变为Cu 2+,反应离子方程式为CuCl++Ag+=AgCl↓+Cu2+
,故答案为:CuCl++Ag+=AgCl↓+Cu2+.
点评 本题考查化学平衡计算、外界条件对化学平衡移动影响、盖斯定律等知识点,侧重考查学生图象分析、判断及计算能力,注意:只有反应前后改变的物理量才能作为平衡判断依据,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 100mL0.5mol•L-1 HCl溶液 | ||
| C. | 200mL0.25mol•L-1 KCl溶液 | D. | 100mL0.5mol•L-1NaClO溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500s | 1 000s |
| c(H2)/(mol•L-1) | 5.00 | 3.52 | 2.48 |
| c(CO)/(mol•L-1) | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂可以提高单位时间氨的产量 | |
| B. | 高压有利于氨的合成反应 | |
| C. | 500℃高温比室温更有利于合成氨的反应 | |
| D. | 恒温恒容下,在合成氨平衡体系中充入He,使压强增大,则平衡正向移动,NH3增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com