
| A. | 加水稀释,盐溶液中各离子的物质的量浓度均将减小 | |
| B. | 常温下反应4Fe(OH)2+O2+2H2O═4Fe(OH)3能自发进行,则△H<0 | |
| C. | 足量的锌与等体积等pH的HA、HB溶液分别反应,HA放出的氢气少说明是强酸 | |
| D. | 葡萄糖中花青素在碱性环境下显紫色,故可用苏打粉检验假红酒 |
分析 A.加水稀释水解显酸性的盐溶液中,氢氧根离子浓度增大,水解显碱性的盐溶液中氢离子浓度增大;
B.△G=△H-T△S<0的反应能够自发进行;
C.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大;
D.苏打是碳酸钠,其溶液呈碱性,葡萄中的花青素在碱性环境下显紫色.
解答 解:A.加水稀释水解显酸性的盐溶液中,如NH4Cl溶液中NH4+水解溶液显酸性,溶液中存在离子积常数,稀释后c(H+)减小,则c(OH-)增大,水解显碱性的盐溶液中,溶液CH3COONa中,醋酸根离子水解显碱性,溶液中存在离子积常数,加水稀释,c(OH-)减小,c(H+)增大,若为NaCl溶液加水稀释,溶液中钠离子和氯离子浓度减小,c(H+)和c(OH-)不变,故A错误;
B.常温下反应4Fe(OH)2+O2+2H2O═4Fe(OH)3能自发进行,满足△H-T△S<0,反应前后气体体积减小,则△S<0,所以只有当△H<0时,常温下△H-T△S<0,故B正确;
C.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大,足量的锌与等体积等pH的HA、HB溶液分别反应,HA放出的氢气少,所以HA的浓度小于HB,两种溶液中PH相同,氢离子浓度相等,说明HA的电离程度大,HA酸性强,但不能说明HA为强酸,故C错误;
D.苏打是碳酸钠,为强碱弱酸盐,其溶液呈碱性,葡萄中的花青素在碱性环境下显紫色,所以无法鉴别,故D错误;
故选B.
点评 本题考查有机物鉴别、酸强弱判断、焓变和熵变、盐溶液稀释等知识点,为高频考点,综合性较强,把握盐类水解、物质性质差异性、反应方向和限度判断原理是解本题关键,注意A中要根据盐特点来分析判断,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
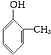 的类别是:酚.
的类别是:酚.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(H+)<c(OH-) | B. | c(HCN)<c(CN-) | ||
| C. | c(CN-)+c(OH-)=0.1mol?L-1 | D. | c(HCN)+c(CN-)=0.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
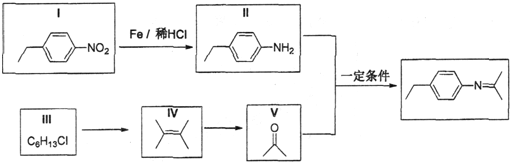
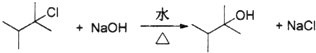
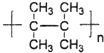
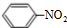 ,Z的结构简式为
,Z的结构简式为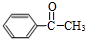
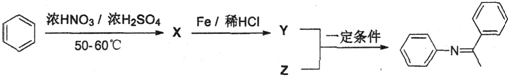
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质灼烧时,火焰颜色为黄色,则该物质为金属钠 | |
| B. | 工业制造镁粉是将镁蒸气放在氮气中冷却 | |
| C. | 钠的化学性质很活泼,所以在自然界中只能是以游离态的形式存在 | |
| D. | 钠钾合金可以用于快中子反应堆作热交换剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com