
���� ��1������Ϊ��Ԫ�ᣬ����Ϊǿ�ᣬ����Ϊ���
��2��ͬ���ͬ���ʵ���Ũ�ȵ������ᣬ�������������ʵ�����ȣ�������Ϊ��Ԫ�
��3����ͬŨ��ʱ���������������Ũ��Խ����������ʵ���Ũ����С��
��4��NH4ClΪǿ�������Σ�ˮ������ԣ�
��5����Ԫ�����Ӧ���Σ��Ե�һ��ˮ��Ϊ����
��6��NaHCO3Ϊǿ�������Σ�ˮ��ʼ��ԣ�
��� �⣺��1������Ϊ��Ԫ�ᣬ����Ϊǿ�ᣬ����Ϊ���ᣬ���ʵ���Ũ����ͬʱ��c��H+���ɴ�С��˳����b��a��c���ʴ�Ϊ��b��a��c��
��2��ͬ���ͬ���ʵ���Ũ�ȵ������ᣬ�������������ʵ�����ȣ�������Ϊ��Ԫ�ᣬ���к�ͬ���ʵ���Ũ�ȵ�NaOH���ĵ�����ɴ�С��˳����b��a=c���ʴ�Ϊ��b��a=c��
��3����ͬŨ��ʱ���������������Ũ��Խ����������ʵ���Ũ����С���������ʵ���Ũ����С����H2SO4�����ᣩ�������Ǵ��ᣬ�ʴ�Ϊ��c��a��b��
��4��NH4ClΪǿ�������Σ�ˮ������ԣ�pH��7���ʴ�Ϊ������
��5����Ԫ�����Ӧ���Σ��Ե�һ��ˮ��Ϊ������pHNa2S��NaHS���ʴ�Ϊ������
��6������̼�������������Һ�д���ˮ�ⷴӦ��HCO3-+H2O?H2CO3+OH-��������Һ�ʼ��ԣ�
�ʴ�Ϊ����Һ����HCO3-+H2O?H2CO3+OH-��ˮ��̶ȴ��ڵ���̶ȣ���Һ�ʼ��ԣ�
���� ���⿼��������ʵĵ���������ˮ�⣬Ϊ�߿��ĸ�Ƶ�⣬��Ŀ�ѶȲ�����ȷ������Ӧԭ��Ϊ���ؼ���ע��������ʵĵ����ص������ˮ���ԭ����������ػ���֪ʶ�Ŀ��飬���������ѧ�������Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ѹǿ������Ӱٷ������䣬��ѧ��Ӧ�������� | |
| B�� | �����¶ȣ�����Ӱٷ�������ѧ��Ӧ�������� | |
| C�� | ʹ��������������Ӱٷ�������ѧ��Ӧ�������� | |
| D�� | ���뷴Ӧ�����Ӱٷ�������ѧ��Ӧ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
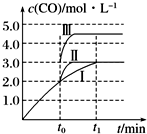 ��ҵ�Ͽ���CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ҵ�Ͽ���CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��| ��ѧ��Ӧ | ƽ�� ���� | �¶�/�� | |
| 500 | 800 | ||
| ��2H2��g��+CO��g��?CH3OH��g�� | K1 | 2.5 | 0.15 |
| ��H2��g��+CO2��g��?H2O��g��+CO��g�� | K2 | 1.0 | 2.50 |
| ��3H2��g��+CO2��g��?CH3OH��g��+H2O��g�� | K3 | ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A��ʢ��ŨH2SO4��B��ʢ���Ҵ�����ˮ�����ƣ�D��ʢ�б���̼������Һ��
ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A��ʢ��ŨH2SO4��B��ʢ���Ҵ�����ˮ�����ƣ�D��ʢ�б���̼������Һ��| �Լ� | ���� | �Ҵ� | ���� | �������� |
| �е㣨�棩 | 34.7 | 78.5 | 118 | 77.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ƥ����--�ɻ������� | B�� | ����--Σ�շ��� | ||
| C�� | ��������--�л����� | D�� | ������--���ɻ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| c��H2��/mol•L-1 | c��Cl2��/mol•L-1 | v/��mol•L-1•s-1�� |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A�� | m=1��n=1 | B�� | m=$\frac{1}{2}$��n=$\frac{1}{2}$ | C�� | m=$\frac{1}{2}$��n=1 | D�� | m=1��n=$\frac{1}{2}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cr2O72-���ܽ�SO2���� | B�� | ��ԭ�ԣ�Cr3+��Fe2+��SO2 | ||
| C�� | �����ԣ�Cr2O72-��Fe3+��SO2 | D�� | ������Ӧ��Fe3+�����ֻ�ԭ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com