
把HNO3质量分数为70%的溶液(密度为1.40g/cm3)加到等体积的水中,稀释后硝酸溶液中溶质的质量分数是
[ ]
A. 0.35 B. <0.35 C. >0.35 D. ≤0.35
科目:高中化学 来源: 题型:阅读理解
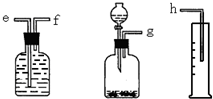 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)银氨溶液的[Ag(NH3)2]+为络离子,它类似于多元弱酸的电离,试写出该络离子第一步电离的电离方程式__________。
(2)在银氨溶液中加入浓HNO3,银氨溶液将被破坏,试结合反应予以解释。
(3)银氨溶液和乙醛反应生成银镜的离子方程式为_________。
(4)做完银镜反应后试管内壁上的银如何除去?
查看答案和解析>>
科目:高中化学 来源: 题型:022
在纯净的试管内加入1mL质量分数为2%的AgNO3溶液,然后一边摇动试管,一边逐滴滴入质量分数为2%的稀氨水,至最初产生的白色沉淀恰好溶解为止,此溶液即为银氨溶液。在此银氨溶液中再滴入3滴乙醛,振荡后把试管放在热水浴中温热。过一会儿即可看到在试管内壁形成光亮的银镜。试回答下列问题。
(1)银氨溶液的[Ag(NH3)2]+为络离子,它类似于多元弱酸的电离,试写出该络离子第一步电离的电离方程式__________。
(2)在银氨溶液中加入浓HNO3,银氨溶液将被破坏,试结合反应予以解释。
(3)银氨溶液和乙醛反应生成银镜的离子方程式为_________。
(4)做完银镜反应后试管内壁上的银如何除去?
查看答案和解析>>
科目:高中化学 来源: 题型:
把70%的HNO![]() 溶液(密度为1.40 g·cm-3)加到等体积水中,稀释后HNO3溶液中溶质的质量分数是()
溶液(密度为1.40 g·cm-3)加到等体积水中,稀释后HNO3溶液中溶质的质量分数是()
A.=0.35 B.<0.35
C.>0.35 D.≤0.35
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com