
| A、20mL2mol/LMgCl2溶液 |
| B、10mL2.5mol/LNaCl溶液 |
| C、25mL1mol/LAlCl3溶液 |
| D、30mL10mol/LKClO3溶液 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、常温常压下11.2L的甲烷气体含有甲烷分子数为0.5NA个 |
| B、24gMg变为Mg2+时失去的电子数为2NA |
| C、32gO2和O3混合气体中含有氧原子的个数为2NA |
| D、1L1mol/LNaCl溶液中含有钠离子的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮化硅陶瓷是新型无机非金属材料属共价化合物 |
| B、C60由原子直接组成的晶体,可用于制造纳米材料 |
| C、纤维素、蛋白质、酚醛树脂都属于天然高分子材料 |
| D、单晶硅常用于制造半导体材料和光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
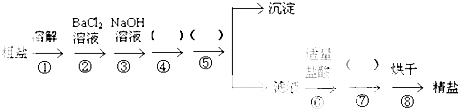
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 200 | 300 | 400 |
| k | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、起始A的物质的量为2mol |
| B、5min时B的转化率为16.67% |
| C、5min时A的浓度为1.5 mol/L |
| D、x=3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com