
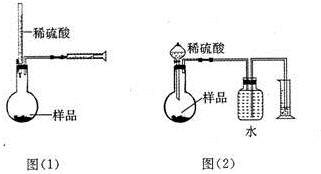
 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.分析 (1)根据在密封条件容器中气体体积不变判断;碳酸钠与硫酸反应产生的二氧化碳的体积为(c-b+a)mL,根据二氧化碳的体积可计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数;
(2)稀硫酸不易挥发,稀盐酸易挥发出,挥发出来的氯化氢对实验有影响;
(3)根据减少二氧化碳的溶解判断,例如可以用饱和碳酸氢钠溶液,或水面上加一层植物油等;
(4)根据反应前后整个装置的质量差可知产生的二氧化碳的质量,根据二氧化碳的质量再计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数;
(5)测定NaOH、Na2C03混合物中Na2C03的质量分数,可以用氯化钡或氯化钙将碳酸根离子沉淀,根据沉淀的质量可计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数.
解答 解:(1)根据在密封条件容器中气体体积不变判断可知,当注射器增大的体积与加入水的体积相等时,则可以说明此装量不漏气,碳酸钠与硫酸反应产生的二氧化碳的体积为(c-b+a)mL,则二氧化碳的物质的量为 $\frac{(c-b+a)×1{0}^{-3}}{22.4}$ mol,根据碳元素守恒可知,样品中Na2C03的质量为$\frac{(c-b+a)×1{0}^{-3}}{22.4}$mol×106g/mol=$\frac{106(c-b+a)×1{0}^{-3}}{22.4}$ g,所以Na2C03的质量分数为$\frac{\frac{106(c-b+a)×1{0}^{-3}}{22.4}}{m}$=$\frac{53(c-b+a)}{11200m}$,
故答案为:注射器增大的体积与加入水的体积相等;$\frac{53(c-b+a)}{11200m}$;
(2)稀硫酸不易挥发,稀盐酸易挥发出,挥发出来的氯化氢对实验有影响,所以不能用稀盐酸而要用稀硫酸,
故答案为:稀硫酸不易挥发,稀盐酸易挥发出氯化氢气体,产生误差;
(3)减少二氧化碳的溶解就在就可减小误差,所以可以用饱和碳酸氢钠溶液,或水面上加一层植物油等,
故答案为:将水换成饱和NaHCO3溶液,或在贮水瓶中的水面上加一层植物油都可防止CO2溶于水;
(4)根据反应前后整个装置的质量差可知产生的二氧化碳的质量,根据二氧化碳的质量再计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数,所以除了测定样品的质量,还需测定的另两个数据是反应前装有药品的整个装置的质量,反应后整个装置的质量,
故答案为:反应前装有药品的整个装置的质量;反应后整个装置的质量;
(5)测定NaOH、Na2C03混合物中Na2C03的质量分数,可以用氯化钡或氯化钙将碳酸根离子沉淀,根据沉淀的质量可计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数,所以实验方法为称量一定质量的样品配成溶液,加入足量的BaCl2溶液后得到沉淀,将沉淀进行过滤、洗涤、干燥、冷却、称量.由沉淀(BaCO3)质量计算出Na2CO3的质量,最后计算出Na2CO3的质量分数,
故答案为:称量一定质量的样品配成溶液,加入足量的BaCl2溶液后得到沉淀,将沉淀进行过滤、洗涤、干燥、冷却、称量.由沉淀(BaCO3)质量计算出Na2CO3的质量,最后计算出Na2CO3的质量分数.
点评 本题以NaOH、Na2C03混合物中Na2C03的质量分数的测定载体,考查了实验方案的设计、质量分数的计算等知识,内容较多,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向KCl溶液中滴加几滴酚酞试液,溶液颜色变红 | |
| B. | 向KI溶液中通入适量Cl2后,溶液颜色变深 | |
| C. | 溴水与NaCl溶液混合时,会发生置换反应 | |
| D. | NaCl溶液在空气中会被氧化,故需要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①②③ | C. | ⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蓝色石蕊试纸检验溶液的酸性 | |
| B. | 量筒可用于配制溶液,但不能作为反应容器使用 | |
| C. | 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释 | |
| D. | 向燃着的酒精灯中加酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4的吸水性和酸性 | |
| B. | 浓H2SO4的脱水性和吸水性 | |
| C. | 浓H2SO4的强氧化性和吸水性 | |
| D. | 浓H2SO4的吸水性和稀H2SO4的通性(酸性) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅能与水反应 | |
| B. | 用二氧化硅制取单质硅,当生成2.24 L(标准状况下)气体时,得到2.8g硅 | |
| C. | 二氧化硅属于传统的无机非金属材料 | |
| D. | 二氧化硅不能与碳酸钠溶液发生反应,但在高温下能与碳酸钠固体发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在船舶的外壳装上铜块可防止其发生电化学腐蚀 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| C. | MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 | |
| D. | 用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | … |
| … | C2H6 | C5H12 | C8H18 | … | … | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com