
| A. | 在0.1mol/L的NaHSO4溶液中,含阳离子总数为0.2NA | |
| B. | 由2gH2、88gCO2、36gH2O组成的混合气体,密度约是相同状况下O2密度的0.79倍 | |
| C. | 1molAl与足量Na0H溶液反应生成H2的体积为33.6L | |
| D. | 56gFe单质与足量S单质在加热条件下充分反应,转移电子数为3NA |
分析 A.溶液体积未知;
B.先根据M=$\frac{m}{M}$求混合气体的平均摩尔质量,根据密度之比等于摩尔质量之比来解答;
C.气体状况未知;
D.铁与硫反应生成硫化亚铁.
解答 解:A.溶液体积未知,无法计算阳离子数目,故A错误;
B.2gH2、88gCO2、36gH2O物质的量分别为1mol,2mol,2mol,平均摩尔质量为:$\frac{(2+88+36)g}{5mol}$=25.2g/mol,密度约是相同状况下O2密度的:$\frac{25.2}{32}$=0.79,故B正确;
C.气体状况未知,无法计算氢气的物质的量,故C错误;
D.铁与硫反应生成硫化亚铁,56g铁生成1mol二价铁离子,转移电子数为3NA,故D错误;
故选B.
点评 本题考查了物质的量有关计算,明确以物质的量为核心计算公式、熟悉相对密度概念、气体摩尔体积使用条件和对象是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,溶液中c(CH3COO-):①<② | |
| B. | 加水稀释①,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| C. | 向②中滴加①至溶液呈中性,滴加过程中水的电离平衡正向移动 | |
| D. | 向②中滴加①至溶液呈中性,溶液中c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
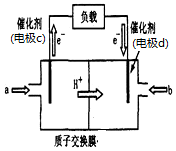 火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.
火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H1 H2(g)+Cl2(g)═2HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21:5 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5ml待测液加入维生素C,振荡,再加入1mlM溶液,加入至蒸馏水10mL,再振荡,与③好色阶对比 | 紫红色比③色阶浅 | 维生素C可以有效降低NaNO2的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com