
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Ca2+、K+、Cl- | D. | NO3-、K+、ClO-、Ca2+ |
分析 加入铝粉能放出氢气的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或企业改革离子,
A.铵根离子与氢氧根离子反应,碳酸根离子与氢离子反应,酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气;
B.镁离子、碳酸氢根离子与氢氧根离子反应,碳酸氢根离子与氢离子反应;
C.碱性溶液中,四种离子之间不反应,都不与氢氧根离子反应;
D.次氯酸根离子具有强氧化性,与铝反应不会生成氢气.
解答 解:加入铝粉能放出氢气的溶液中存在大量氢离子或氢氧根离子,
A.NH4+与氢氧根离子反应,CO32-与氢离子反应,NO3-在酸性条件下与铝反应不会生成氢气,在溶液中一定不能大量共存,故A错误;
B.Mg2+、HCO3-与氢氧根离子反应,HCO3-与氢离子反应,在溶液中一定不能大量共存,故B错误;
C.NO3-、Ca2+、K+、Cl-之间不反应,都不与氢氧根离子反应,在碱性溶液中可以共存,故C正确;
D.ClO-具有强氧化性,加入铝后不会生成氢气,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性 | B. | 碱性 | C. | 氧化性 | D. | 还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
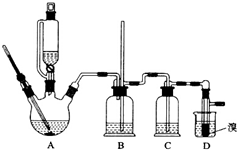 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4s时c(B)为0.76mol/L | |
| B. | 830℃达平衡时,A的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中的溶液没有恢复到室温就转移到容量瓶,一定会导致结果偏高 | |
| B. | 没有洗涤烧杯和玻璃棒,一定会导致结果偏低 | |
| C. | 容量瓶使用时没有干燥会导致结果偏低 | |
| D. | 使用量筒量取浓溶液后,没有把洗涤量筒得到洗涤液转移到容量瓶,会导致结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 蔗糖 | 硫酸钾 | 阿司匹林 | 高锰酸钾 | 硝酸银 |
| 质量(g) | 25.00 | 0.174 | 0.17 | 0.316 | 0.340 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com