
| A. | 中子数为10的氧原子:${\;}_8^{10}O$ | B. | Mg2+的结构示意图: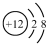 | ||
| C. | 硫化钠的电子式: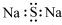 | D. | 甲酸甲酯的结构简式:C2H4O2 |
分析 A.中子数+质子数=质量数,结合原子表示方法分析判断,质量数标记在元素符号左上角,质子数标记在左下角;
B.镁离子是镁原子失去最外层2个电子形成;
C.硫化钠是钠离子和硫离子形成的离子化合物,电子式中需要标记阴阳离子;
D.结构简式需要表示出结构特征和官能团;
解答 解:A.中子数为10的氧原子,质子数为8,则质量数为18,则原子表示为${\;}_8^{18}O$,故A错误;
B.镁离子是镁原子失去最外层2个电子形成,离子的结构示意图为: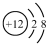 ,故B正确;
,故B正确;
C.硫化钠的化学式中含有两个钠离子,硫化钠正确的电子式为: ,故C错误;
,故C错误;
D.甲酸甲酯的结构简式:HCOOCH3,C2H4O2为甲酸甲酯的分子式,故D错误;
故选B.
点评 本题考查了化学用语的规范应用和书写方法,注意检查的熟练掌握,题目较简单.


科目:高中化学 来源: 题型:实验题

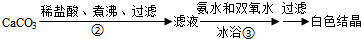
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 《神农本草经》记载,麻黄能“止咳逆上气” | 碳酸氢钠药片 |  |  |
| 古代中国人已用麻黄治疗咳嗽 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 贴有该标志的物品是可回收物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
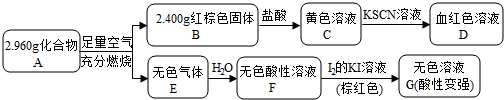
 ,写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑;
,写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(OH-)>c(H+)>c(Na+)>c(CH3COO-) | D. | c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)═C(s)+2 H2(g)的△H=74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,则反应释放能量 | |
| B. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 | |
| C. | 钠原子与氯原子结合生成氯化钠后,其结构的稳定性增强,体系的能量降低 | |
| D. | 当断开旧键吸收的能量大于形成新键放出的能量时,该反应为吸收能量的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、H+、Cl-、Mg2+可以大量共存 | |
| B. | 与KSCN溶液反应产生红色沉淀 | |
| C. | 加入铜粉,反应的离子方程式为:Cu+Fe3+=Cu2++Fe2+ | |
| D. | 向该溶液中滴入少量Na2S溶液,反应的离子方程式为:2Fe3++3S2-+6H2O=3H2S↑+2Fe(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com