
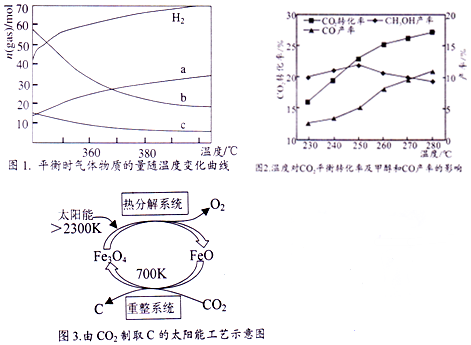
分析 已知①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(1)△H1=akJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2=bkJ•mol-1
③H2O(g)=H2O(l)△H3=ckJ•mol-1
根据盖斯定律知,③×2+①-③得:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
(2)根据图知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应,a曲线随着温度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯,据此判断b曲线代表物质;
(3)①反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高;
(3)②据图示进行分析250℃甲醇转化率最高;由CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-8 可知提高CO2转化为CH3OH平衡转化率,应使平衡向正向移动,可降低温度,增大浓度;
(4)电解时,二氧化碳在b极上得电子发生还原反应生成乙醇;
(5)该反应中Fe元素化合价由+3价变为+2价,O元素化合价由-2价变为0价,根据转移电子和Fe3O4之间的关系式计算;根据图知,反应物是二氧化碳和FeO,生成物的四氧化三铁和C,反应条件是700K.
解答 解:已知①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(1)△H1=akJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2=bkJ•mol-1
③H2O(g)=H2O(l)△H3=ckJ•mol-1
根据盖斯定律知,②×3-①-③得:CO2(g)+3H2(g)?CH3OH(g)+H2O(g))△H=(3b-a-c)kJ•mol-1,
故答案为:3b-a-c;
(2)根据图知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应,a曲线随着温度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯,所以b曲线代表H2O,
故答案为:H2O;
(3)①由图2可知温度升高CO的产率上升,其主要原因可能是反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高,
故答案为:反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高;
(3)②据图示进行分析250℃甲醇转化率最高,故获取CH3OH最适宜的温度是250℃;
A.使用催化剂,平衡不移动,不能提高转化率,故A错误;
B、增大体系压强,平衡向正方向移动,提高甲醇转化率,故B正确;
C、增大CO2和H2的初始投料比,可增大氢气的转化率,二氧化碳的转化率减小,故C错误;
D、投料比不变,增加反应物的浓度,平衡正向移动,可增大转化率,故D正确;
故答案为:250℃;BD;
(4)电解时,二氧化碳在b极上得电子发生还原反应生成C2H5OH,电极反应式为2CO2+12H++12e-=C2H5OH+3H2O,
故答案为:2CO2+12H++12e-=C2H5OH+3H2O;
(5)该反应中Fe元素化合价由+3价变为+2价,O元素化合价由-2价变为0价,分解2mol四氧化三铁转移4mol电子,则分解1mol四氧化三铁转移2mol电子;根据图知,反应物是二氧化碳和FeO,生成物的四氧化三铁和C,反应条件是700K,反应方程式为6FeO(S)+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4(S)+C,
故答案为:2mol;6FeO(S)+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4(S)+C.
点评 本题考查影响平衡移动的因素、热化学方程式的书写、氧化还原反应有关计算,为高频考点,注意四氧化三铁中Fe元素化合价,难点是电极反应式的书写,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O | 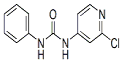 | 白色结晶粉末 | 170~172°C | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.
(1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.| 滴定次数 | 待测液体积(mL)[来源 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
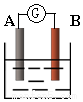 如图为原电池装置示意图:
如图为原电池装置示意图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com