
【题目】胰蛋白酶作用于一定量的某种物质(底物),温度保持37 ℃,pH保持在最适值,生成物量与反应时间关系如下图。请回答下列问题。

(1)该酶作用的底物是 。
(2)在140 min后,曲线变成水平,这是因为
________________________________________________________________________。
(3)若增加胰蛋白酶浓度,其他条件不变,请在原图上画出生成物量变化的示意曲线。
(4)若胰蛋白酶浓度和其他条件不变,反应液pH由2逐渐升高到10,则酶催化反应的速率将________,原因是____________________________________。
(5)下图中能正确表示胰蛋白酶对底物的分解速率和温度关系的是( )
【答案】(1)蛋白质 (2)底物量一定,底物已被耗尽
(3)见下图
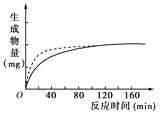
(4)不变 在pH为2时酶已失活 (5) C
【解析】
本题考查酶,考查对酶的作用、影响酶促反应速率因素的理解。胰蛋白酶的最适pH略大于7,最适温度约为37°C,据此可结合题干文字信息和坐标中横坐标判断环境条件变化时胰蛋白酶活性的变化。
(1)根据酶的专一性,胰蛋白酶催化的反应应是蛋白质的水解,作用的底物是蛋白质。
(2)酶在反应中起催化作用,不改变生成物的量,在120 min后,曲线变成水平,原因是底物的量一定,被彻底水解后生成物的量不变。
(3)增加胰蛋白酶浓度,其他条件不变,可以提高反应速率,但不能改变生成物的量。曲线应高于原曲线,但最高点不变。
(4)胰蛋白酶的最适pH略大于7,在pH大于2时会变性失活,且不可恢复,反应液pH由2逐渐升高到10,胰蛋白酶催化反应的速率不会改变。
(5)在低于最适温度时,酶活性随温度升高而升高,超过最适温度,酶活性会随温度升高而降低,胰蛋白酶的最适温度约为37°C,图中能正确表示胰蛋白酶对底物的分解速率和温度关系的是C。


科目:高中化学 来源: 题型:
【题目】下列反应属于四种基本反应类型,但不属于氧化还原反应的是( )
A. Fe+CuSO4═FeSO4+Cu B. CO+CuO![]() Cu+CO2
Cu+CO2
C. AgNO3+NaCl═AgCl↓+NaNO3 D. 2FeCl2+Cl2═2FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸法是在一定温度下盐酸与铝土矿、高岭土或粉煤灰等固体中的活性Al2O3发生反应制备Al2O3的工艺。氯化铝溶液可通过蒸发结晶生成结晶氯化铝,进而焙烧得到氧化铝;也可利用氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低的特点,生成氯化铝晶体,从而焙烧得到氧化铝。图1是我国某公司研发的具有自主知识产权的“一步酸溶法”工艺流程。
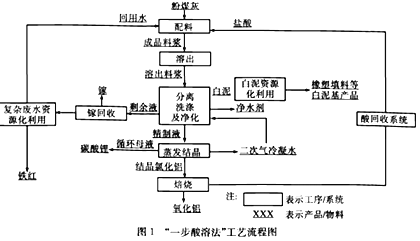
回答下列问题:
(1)“氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低”的原因是________________________________________________________(结合必要的化学方程式说明)。
(2)精制液蒸发结晶后分离出纯净结晶氯化铝的操作名称是_______,用_____洗涤。
(3)写出结晶氯化铝(AlCl3·6H2O)焙烧的化学方程式:_____________________________。
(4)工业上冶炼金属铝的方法是电解熔融的_______(填化学式),电解过程中作阳极的石墨易消耗,原因是___________________________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是
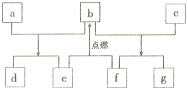
A. 简单离子的半径:Y>Z>X
B. 简单氢化物的沸点:Y>X
C. 最高价氧化物对应水化物的碱性:Z>Y
D. W、Y的氧化物所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子或离子的电子排布式或排布图正确的是________(填序号,下同),违反能量最低原理的是____________,违反洪特规则的是________,违反泡利原理的是________。
①Ca2+:1s22s22p63s23p6 ②F-:1s22s23p6
③P:![]() ④Cr:1s22s22p63s23p63d44s2
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2 ⑥Mg2+:1s22s22p6⑦C:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com