
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个。请回答下列问题:
(1)B元素的名称为___________,D的元素符号为___________,E的离子结构示意图为___________。
(2)D、E两种元素可形成化学式为DE2、D2E2等化合物,则DE2的电子式为___________________,D2E2的结构式为___________(请填写具体物质的化学式)。
(3)将B2A2投入到B2D的水溶液中可生成D的单质,发生反应的离子方程式为:______________________,请用单线桥标出此反应中电子转移的方向和数目。
(4)DA2与E元素的单质在水中反应的离子方程式为:_________________________________。
(5)向由C、E两种元素组成的化合物溶液400mL1 mol/L中加入500mL—定物质的量浓度的KOH溶液,得到白色沉淀15.6 g,则KOH溶液的物质的量浓度为___________mol/L或___________mol/L。
【答案】钠 S 
![]() Cl—S—S—Cl
Cl—S—S—Cl  SO2+Cl2+2H2O=4H++2Cl-+SO42- 1.2 2.8
SO2+Cl2+2H2O=4H++2Cl-+SO42- 1.2 2.8
【解析】
短周期主族元素A、B、C、D、E的原子序数依次增大,A原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;A、D同主族,则D为S元素;E的原子序数最大,故E为Cl;B是短周期元素中原子半径最大的主族元素,则B为Na;C原子的质子数比B原子的质子数多2个,则C为Al,据此解答。
(1)由上述分析可以知道,B元素的名称为:钠,D的元素符号为:S,E的离子为Cl-,离子结构示意图为 ,
,
因此,本题正确答案是:钠;S; ;
;
(2)SCl2分子中S原子与Cl之间形成1对共用电子对,电子式为![]() ,S2Cl2分子中S原子之间形成1对共用电子对,S原子与Cl原子之间形成1对共用电子对,结构式为Cl—S—S—Cl;
,S2Cl2分子中S原子之间形成1对共用电子对,S原子与Cl原子之间形成1对共用电子对,结构式为Cl—S—S—Cl;
因此,本题正确答案是:![]() ;Cl—S—S—Cl;
;Cl—S—S—Cl;
(3) Na2O2和Na2S的水溶液发生氧化还原反应生成硫的单质,根据得失电子守恒和电荷守恒,反应的离子方程式为:Na2O2+S2-+2H2O=S+2Na++4OH-;过氧化钠得电子,S2-失电子,则用单线桥标出此反应中电子转移的方向和数目为: ,
,
因此,本题正确答案是: ;
;
(4)SO2与氯气在水中反应生成HCl与硫酸,反应的离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-,
因此,本题正确答案是:SO2+Cl2+2H2O=4H++2Cl-+SO42-;
(5)向由C、E两种元素组成的化合物为AlCl3,其物质的量为0.2L×2mol/L=0.4mol,如完全生成沉淀,则应生成0.4molAl(OH)3,实际得到白色沉淀15.6g,物质的量为![]() =0.2mol<0.4mol,说明Al3+没有完全生成沉淀,可能存在两种情况:
=0.2mol<0.4mol,说明Al3+没有完全生成沉淀,可能存在两种情况:
①NaOH不足,铝离子部分转化氢氧化铝沉淀,则:
Al3++3OH-=Al(OH)3↓,
0.6mol 0.2mol
此时c(NaOH)=![]() =1.2mol/L,
=1.2mol/L,
②NaOH部分过量,铝离子转化为氢氧化铝沉淀、偏铝酸根,则:
Al3++3OH-=Al(OH)3↓
0.4mol 1.2mol 0.4mol
溶解的氢氧化铝为0.4mol-0.2mol=0.2mol
Al(OH)3+OH-=AlO2-+2H2O,
0.2mol 0.2mol
则c(NaOH)=![]() =2.8mol/L,
=2.8mol/L,
因此,本题正确答案是:1.2;2.8。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在酸性溶液中,能大量共存的是离子组是 ( )
A.Mg2+、Fe2+、NO3-、SCN-B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3-D.Na+、Ba2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成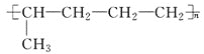 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 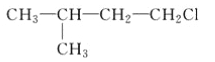 B.
B. 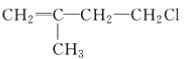 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 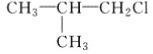
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
B.将CO2通入BaCl2溶液可生成BaCO3沉淀
C.将CO2通入次氯酸钙溶液可生成次氯酸
D.0.12g石墨中含有6.02×1022个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物 WX2,Y原子内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
A. WX、WX2、ZX2的化学键类型完全相同
B. WZ2分子中所有原子最外层都满足8电子结构
C. 由于X的常见氢化物(H2X)分子间存在氢键,故H2X比H2Z 稳定
D. 原子半径大小顺序为X<W<Z<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】先用特殊方法把固体物质加工成纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后再制成纳米材料是制造纳米材料的一种工艺。下列分散系中的分散质的微粒直径比纳米材料中超细粉末粒子还要小的是
A.悬浊液B.乳浊液C.溶液D.胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或试剂的选择不合理的是 ( )
A. 铁丝能代替铂丝来做焰色反应实验B. 容量瓶用蒸馏水洗涤后须烘干才能使用
C. 用分液漏斗分离水和CCl4混合物D. 用品红溶液鉴别SO2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__________。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是__________,碱性最强的化合物的化学式是__________________。
(3)比较①与⑤的最高价氧化物对应的水化物,________________的酸性强(填化学式)
(4)工业上制取②的氢化物的化学方程式_______________________________________;
②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为_____________。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________________________________________________(用化学方程式表示)
(6)比较③与⑥的氢化物,_______________更稳定,__________沸点更高(填化学式)
(7)写出④的单质与水反应的化学方程式_________________________________________。
(8)写出⑦元素的离子结构示意图______________________,该离子半径_________S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
(4)一种钛镍合金的立方晶胞结构如图所示:

①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com