
(8分)已知:Cu+2H2SO4(浓)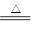 CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。
CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。
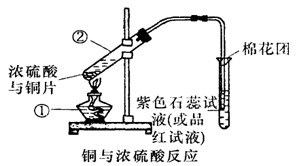
(1)写出标号①的仪器的名称: 。
(2)将产生气体通入品红试液中的现象为: 。
(3)图中棉花团中浸有氢氧化钠溶液,其作用是_________________________ 。
(4)反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应,因此反应完毕,试管中一定还有硫酸剩余。下列药品中能用来证明反应结束后的溶液中确有余酸的有________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:阅读理解
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | 第一份CuSO4溶液 | a | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | b | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | d | 第一份NaBr溶液 | 溶液由蓝色变为蓝绿色 |
| ② | e | 第一份NaBr溶液 | 溶液由蓝色变为草绿色 |
| ③ | f | 第一份NaBr溶液 | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
温度 | 现象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由蓝色变为深绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| △ |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)已知:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。
(1)写出标号①的仪器的名称: 。
(2)将产生气体通入品红试液中的现象为: 。
(3)图中棉花团中浸有氢氧化钠溶液,其作用是_________________________ 。
(4)反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应,因此反应完毕,试管中一定还有硫酸剩余。下列药品中能用来证明反应结束后的溶液中确有余酸的有________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源:2010长沙市一中学业水平考试高三第二次模拟化学试题 题型:实验题
(8分)已知:Cu+2H2SO4(浓)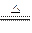 CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。
CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题。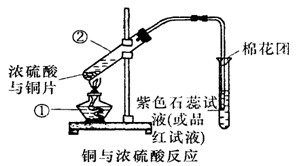
(1)写出标号①的仪器的名称: 。
(2)将产生气体通入品红试液中的现象为: 。
(3)图中棉花团中浸有氢氧化钠溶液,其作用是_________________________ 。
(4)反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应,因此反应完毕,试管中一定还有硫酸剩余。下列药品中能用来证明反应结束后的溶液中确有余酸的有________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com