
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是

A.对应简单离子半径:X>W
B.对应气态氢化物的稳定性Y>Z
C.化合物XZW既含离子键,又含共价键
D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:填空题
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:

(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 0.3000 | 1.02 | 24.04 |
2 | 0.3000 | 2.00 | 25.03 |
3 | 0.3000 | 0.20 | 23.24 |
表1. KMnO4标准溶液滴定数据
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:填空题
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:

①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1=-57.3 kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,44 g CO2含有nA个C原子
B.1 L 0.1 mol·L-1 Na2S溶液中含有0.1 nA个S2—
C.0.1 mol Na与足量O2反应,转移0.2 nA个电子
D.标准状况下,22.4 L 的CCl4含有4 nA个Cl原子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)工业合成氨与制备硝酸一般可连续生产,流程如下:
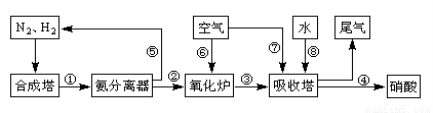
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
T/℃ | T1 | 300 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
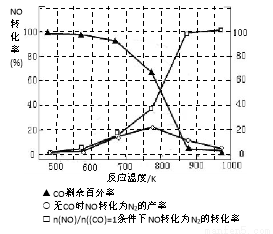
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如图。据图分析,若不使用CO,温度超过775K,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ. AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:KSCN溶液、NaOH溶液、氯水、KMnO4溶液。
⑴请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入 ,振荡 |
| 存在Fe3+ |
取少量除尽Ag+后的溶液于试管中,加入1~2滴KMnO4溶液,振荡 |
| 存在Fe2+ |
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ. AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
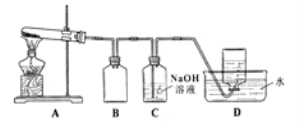
Ⅱ.⑵装置B的作用是 。
⑶经小组讨论并验证该无色气体为O2,其验证方法是 。
⑷【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:① Ag;② Ag2O;③ Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为 。
【实验拓展】取2.0g AgNO3样品充分受热分解,共收集到标况下气体的体积为336mL,则样品中AgNO3的百分含量为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列有关物质的性质和该性质的应用均正确的是( )
A.常温下浓硫酸能使铝发生钝化,故可在常温下用铝制容器贮藏运输浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
下列实验的现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将新制氯水滴到淀粉KI试纸上 | 试纸变蓝色 | 氧化性:I2>Cl2 |
B | 将过量的CO2通入CaCl2溶液中 | 产生白色沉淀 | 酸性:HCl>H2CO3 |
C | FeSO4溶液中滴入酸性高锰酸钾溶液 | 紫色褪色 | Fe2+有还原性 |
D | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com