
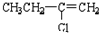 (C)
(C)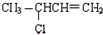 (D)
(D)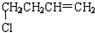
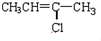 (G)
(G)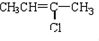 (H)
(H)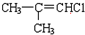
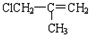 (J)
(J)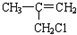
科目:高中化学 来源: 题型:选择题
| A. | 单位时间生成n摩尔A,同时生成3n摩尔B | |
| B. | A,B,C的浓度不再变化 | |
| C. | A,B,C的分子数之比为1:3:2 | |
| D. | V正=V逆=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
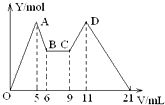 向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )| A. | 从6到9,相应离子反应方程式为H++OH-=H2O | |
| B. | A 是NaOH,B是盐酸,且c(NaOH):c( HCl)=2:1 | |
| C. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| D. | A是盐酸,B是NaOH,且c(NaOH)=2c (HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气在光照条件下的反应和乙酸与乙醇生成乙酸乙酯的反应均属于取代反应 | |
| B. | 顺-2-丁烯和反-2-丁烯的熔、沸点不相同 | |
| C. | C4H9Br的同分异构体有3种 | |
| D. | 乙烯、苯分子中的所有原子都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
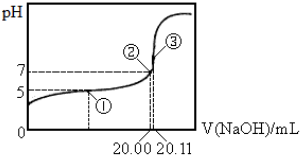
| A. | 该温度下CH3COOH的电离平衡常数约为1.8×10-5 | |
| B. | 点①处溶液中c(CH3COO-)<c(CH3COOH) | |
| C. | 点③处溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(OH-)>c(Na+)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;
(1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 简单离子半径:W>Y>Z | |
| B. | X与Y可形成既含极性键又含非极性键的化合物 | |
| C. | Z与W形成的化合物一定是离子化合物 | |
| D. | Y的氧化物对应的水化物的酸性一定比W的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com