
| A、甲烷的标准燃烧热为-890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出的热量为 19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 |
| C、S(s)+O2(g)═SO2(g)△H=-296.8 kJ?mol-1(反应热) |
| D、2NO2═O2+2NO△H=+116.2 kJ?mol-1(反应热) |


科目:高中化学 来源: 题型:
| A、5:1 | B、1:5 |
| C、1:1 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol?L-1 醋酸 |
| B、0.5 mol?L-1盐酸 |
| C、0.5 mol?L-1硫酸 |
| D、0.5 mol?L-1硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| B、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL 3.0 mol?L-1NaCl溶液 |
| B、75mL 1.0 mol?L-1CaCl2溶液 |
| C、150 mL 1.0mol?L-1KCl溶液 |
| D、100 mL 0.5 mol?L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O/H+ |

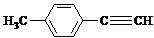 )的一条路线如下:
)的一条路线如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com