
分析 某元素的原子序数为24,原子核外有24个电子,基态原子核外电子排布式为1s22s22p63s23p63d54s1,据此解答.
解答 解:某元素的原子序数为24,原子核外有24个电子,基态原子核外电子排布式为1s22s22p63s23p63d54s1,
(1)此元素原子的电子总数是24;
故答案为:24;
(2)基态原子核外电子排布式为1s22s22p63s23p63d54s1,有4个能层,有7个能级,
故答案为:4;7;
(3)它的价电子排布式是3d54s1,价电子数为6,故答案为:3d54s1;6;
(4)该原子位于第四周期第ⅥB族,故答案为:四、副族;
(5)3d、4s能级电子为单电子,有6个未成对电子,
故答案为:6.
点评 本题综合考查原子核外电子排布以及原子结构与元素周期表知识,侧重考查原子的电子排布及区的划分等,明确原子的电子排布式、元素在周期表中的位置、元素所处主族是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3水解生成的Fe(OH)3胶粒数为NA | |
| B. | 密闭容器中,28gN2和6gH2充分反应,产物的分子数为2NA | |
| C. | 标准状况下,22.4LCO2与足量Na2O2反应转移的电子数为NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量Cu共热,生成SO2的分子数为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S+O2 $\frac{\underline{\;点燃\;}}{\;}$SO2 | B. | Fe(OH)3+3HCl═FeCl3+3H2O | ||
| C. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | D. | 4HNO3(浓)$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中,0族元素的原子半径最小 | |
| B. | 现已发现的ⅡA族元素的单质在常温常压下都是固体 | |
| C. | ⅦA族元素的原子,其半径越大,越容易得到电子 | |
| D. | 所有的主族元素的简单离子所带电荷与其族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;其燃烧含碳产物的结构式为:O=C=O;CH4与Cl2生成CCl4的化学方程式CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl.
;燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;其燃烧含碳产物的结构式为:O=C=O;CH4与Cl2生成CCl4的化学方程式CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
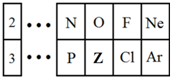 如图是元素周期表的一部分,请回答下列问题.
如图是元素周期表的一部分,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.6NA | |
| B. | 60 g SiO2晶体中含有2NA个Si-O键 | |
| C. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在两种溶液中分别加入少量稀硫酸,加热,再加入碱中和硫酸,再加入银氨溶液,水浴加热 | |
| B. | 测量溶液的导电性 | |
| C. | 向两种溶液中分别滴加硝酸银溶液 | |
| D. | 尝味道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com