
| A、酸性高锰酸钾 | B、液溴 |
| C、硝化反应 | D、溴水 |


科目:高中化学 来源: 题型:
 可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.
可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 氢氧化钠 碳酸钠 硫酸铜 |
| B、盐酸 硝酸银 氯化钠 硝酸钠 |
| C、氢氧化钠 硫酸镁 氯化钠 盐酸 |
| D、氯化钡 硫酸钠 氯化钙 硝酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、将含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 去氢 |
| 加氢 |
| 被氧气氧化 |
| 催化剂 |
| A、A是乙炔,B是乙烯 |
| B、A是乙醇,B是乙醛 |
| C、A是乙烯,B是乙烷 |
| D、A是环己烷,B是苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
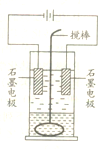 在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图所示.接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.回答:
在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图所示.接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

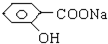
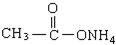
| A、全部 | B、仅①②③④ |
| C、仅①④⑤ | D、仅①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com