
【题目】N2(g)与H2(g)在一定条件下经历如下过程生成NH3(g)。下列说法正确的是

A.I中破坏的均为极性键
B.Ⅱ、Ⅲ、Ⅳ均为吸热过程
C.Ⅳ中NH2与H2生成NH3
D.该条件下生成1molNH3放热54kJ
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
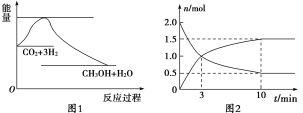
(1)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2 mol CO2和8 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =________;
②该反应的平衡常数表达式K=________。
(2)830 ℃,反应的平衡常数K=1,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有________(填“A”“B”“C”或“D”)。
物质 | A | B | C | D |
n(CO2) | 3 | 1 | 3 | 1 |
n(H2) | 2 | 2 | 4 | 2 |
n(CH3OH) | 1 | 2 | 3 | 0.5 |
n(H2O) | 4 | 2 | 3 | 2 |
(3)25 ℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3 kJ的热量,写出该反应的热化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01mol·L1 KMnO4溶液,几滴浓H2SO4 | 2mL0.3mol·L1H2C2O4 溶液 | 2 | 褪为无色 |
b | 4mL0.01mol·L1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:_____________。
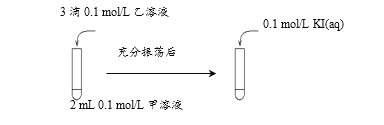
(2)实验I试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:________。
(3)瑛瑛和超超查阅资料,实验I试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验III | 实验IV | ||
实验操作 |
|
|
|
实验现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
实验IV的目的是:_______________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72- 浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i.MnO2与H2C2O4反应生成了Mn2+。
过程ii.__________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001molMnO2加入到6mL____________中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到_______________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() X表示原子:
X表示原子:
①AXn+共有x个电子,则该阳离子的中子数N=____。
②12C16O2分子中的中子数N=______。
③A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为_____。
(2)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是_____。
(3)已知某粒子的结构示意图为![]()
试回答:①当x-y=10时,该粒子为___(填“原子”、“阳离子”或“阴离子”)。
②写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是
A. 辛酸的同分异构体(CH3)3CCH (CH3) CH2COOH的名称为 2,2,3-三甲基戊酸
B. 辛酸的羧酸类同分异构体中,含有3个“一CH3”结构,且存在乙基支链的共有7种(不考虑立体异构)
C. 辛酸的同分异构体中能水解生成相对分子质量为74的有机物的共有8种(不考虑立体异构)
D. 正辛酸常温下呈液态,而软脂酸常温下呈固态,故二者不符合同一通式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:

(1)探究BaCO3和BaSO4之间的转化,实验操作:
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,__________
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是_______。
③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______
(2)探究AgCl和AgI之间的转化,实验Ⅲ:
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。

注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是 _______________
③ 结合信息,解释实验Ⅳ中b<a的原因:______。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A——F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 | A | B | C |
结构简式 |
|
|
|
化合物 | D | E | F |
结构简式 |
|
|
|
(1)化合物A属于________类(按官能团种类分类)
(2)化合物B在一定条件下,可以与NaOH溶液发生反应,写出化合物B 与足量NaOH反应的化学方程式_____________。
(3)化合物C与D在一定条件下发生如图转化得到高分子化合物Z,部分产物已略去。

反应③中D与H2按物质的量1:1反应生成Y,则 生成Z的方程式为__________。
(4)化合物D与银氨溶液反应的化学方程式____________(有机物用结构简式表示):。
(5)写出符合下列条件的E的同分异构体的结构简式:_________。
A.苯环上只有一个取代基
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(6)化合物F是合成“克矽平”(一种治疗矽肺病的药物)的原料之一,其合成路线如下:(说明:克矽平中氮氧键是一种特殊的共价键;反应均在一定条件下进行。)
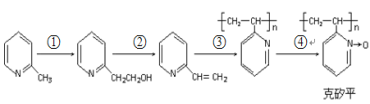
a.反应①是原子利用率100%的反应,则该反应的化学方程式为_____________;
b.上述转化关系中没有涉及的反应类型是(填代号)___________。
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式:
①![]() ; ②
; ②![]() ;
;
③![]() ; ④
; ④![]() 。
。
则下列有关比较中正确的是
A. 电负性:④>③>②>① B. 原子半径:④>③>②>①
C. 第一电离能:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com