
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热为22.68kJ×32=725.8KJ,所以甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1molN三N键共吸收的能量为3×436kJ+946kJ=2254kJ,生成2molNH3,共形成6molN-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为2346kJ-2254kJ=92kJ,N2与H2反应生成NH3的热化学方程式为,N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题考查了热化学方程式的书写方法,主要是燃烧热概念的理解分析,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 利用化学反应可实现12C到14C的转化 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 大量使用燃煤发电是形成雾霾的主要原因 | |
| D. | 晶体硅可用作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 棕红色NO2加压后颜色先变深后变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往某溶液中滴加BaCl2溶液,产生白色沉淀,则原溶液中一定含SO42- | |
| B. | 往某溶液中滴加稀硝酸酸化的硝酸银溶液,产生白色沉淀,则原溶液中一定含Cl- | |
| C. | 取某溶液进行焰色反应,透过蓝色钴玻璃焰色为紫色,则原溶液的溶质一定是钾盐 | |
| D. | 往某溶液中通入CO2,产生白色沉淀,则原溶液中一定含SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
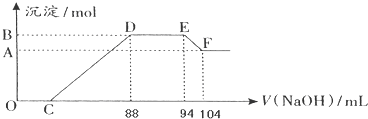
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA | |
| D. | 标况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
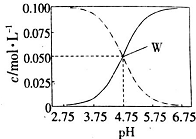 室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )
室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )| A. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO)>c(H+)+c(OH-) | |
| B. | 向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l | |
| D. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com